已知2A(g)+B(g) 2C(g),△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2molA和1molB,在500℃时充分反应达平衡后C的浓度为ωmol/L,放出热量为b kJ。
2C(g),△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2molA和1molB,在500℃时充分反应达平衡后C的浓度为ωmol/L,放出热量为b kJ。
⑴比较a ▲ b(填“>”“=”或“<”)。
⑵下表为不同温度下该反应的平衡常数。由此可推知,表中T1 ▲ T2(填“>” “=”或“<”)。
| T/K |
T1 |
T2 |
T3 |
| K |
1.00×107 |
2.45×105 |
1.88×103 |
若在原来的容器中,只加入2molC,500℃时充分反应达平衡后,吸收热量为c kJ,C的浓度 ▲ (填“>”“=”或“<”)ωmol/L,a、b、c之间满足何种关系 ▲ (用代数式表示)。
⑶ 在相同条件下要想得到2a kJ热量,加入各物质的物质的量可能是 ▲ 。
A. 4molA和2molB B. 4molA、2molB和2molC
C. 4molA和4molB D. 6molA和4molB
⑷为使该反应的反应速率增大,且平衡向正反应方向移动的是 ▲ 。
A. 及时分离出C气体 B. 适当升高温度
C. 增大B的浓度 D. 选择高效催化剂
⑸ 若将上述容器改为恒压容器(反应前体积相同),起始时加入2molA和1molB,500℃时充分反应达平衡后,放出热量为d kJ,则d ▲ b(填“>”“=”或“<”),理由是 ▲ 。
⑹ 在一定温度下,向一个容积可变的容器中,通入3molA和2molB及固体催化剂,使之反应,平衡时容器内气体压强为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4molA、3molB和2molC,则平衡时A的百分含量 ▲ (填“不变”“变大”“变小”或“无法确定”)。
某化学兴趣小组在课外活动中,对某溶液进行了三次检验,每次检验结果如下表所示,请回答下列问题。
| 检验次数 |
溶液中检验出的物质 |
| 第一次 |
KCl、K2SO4、Na2CO3、NH4Cl |
| 第二次 |
BaCl2、Na2SO4、K2CO3、NH4Cl |
| 第三次 |
NaCl、Na2SO4、K2CO3、NH4Cl |
(1)三次检验结果中第次检验结果不正确。
(2)检验时,为了证明溶液中存在SO42-、Cl-、CO32-,取一份溶液,进行下列实验:
第一步:向溶液中滴加过量的(填化学式)溶液,其目的是;
第二步:向溶液中滴加过量的(填化学式)溶液,其目的是;
第三步:过滤,再向滤液中加入少量的(填化学式)溶液,其目的是;
(3)为了确定 NH4+的存在,写出鉴定NH4+的实验方法和现象:。
已知:将SO2通入FeCl3溶液中,溶液颜色会变为浅绿色,其原理可表示为:
□Fe3++□SO2+□H2O —— □Fe2++□SO42-+□H+
(1)请配平上述离子方程式;
(2)若参加反应的SO2在标准状况下的体积为1.12 L,则该反应转移的电子的物质的量为_______mol;
(3)已知向Fe2+溶液中滴加少量硝酸时,溶液由浅绿色变为黄色。则Fe3+、SO42-、HNO3的氧化性强弱顺序为____________。
烯烃A在一定条件下可以按下面的框图进行反应。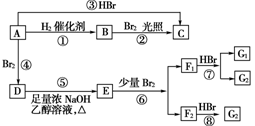
F1和F2互为同分异构体,G1和G2互为同分异构体,D是CCH3BrH3CCCH3BrCH3。
已知1,3-丁二烯与少量溴水加成时有以下两种方式:
CH2CHCHCH2+Br2―→CH2BrCHBrCHCH2(1,2-加成)
CH2CHCHCH2+Br2―→CH2BrCHCHCH2Br(1,4-加成)
试回答下列问题:
(1)A的结构简式为_________________________________________________________。
(2)框图中属于取代反应的是(填数字代号)______________________________________。
(3)框图中①、③、⑥属于________反应。
(4)G1的结构简式为_________________________________________________________。
已知:Ksp(AgCl)=c(Ag+)·c(Cl-)=1.8×10-10,
Ksp(Ag2CrO4)=c2(Ag+)·c(CrO42-)=1.6×10-12,现用0.01 mol/L AgNO3溶液滴定0.01 mol/L KCl和0.001 mol/L K2CrO4混合溶液,通过计算回答:
(1)Cl-、CrO42-先生成沉淀的是________。
(2)当刚出现Ag2CrO4沉淀时,溶液中Cl-浓度是________mol/L。(设混合溶液在反应中体积不变)
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
 (1)合成氨反应反应N2(g)+3H2(g)
(1)合成氨反应反应N2(g)+3H2(g)  2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡移动(填“向左”“向右”或“不”);,使用催化剂反应的ΔH(填“增大”“减小”或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡移动(填“向左”“向右”或“不”);,使用催化剂反应的ΔH(填“增大”“减小”或“不改变”)。 (2)O2 (g)= O+2(g)+e-
(2)O2 (g)= O+2(g)+e- H1="+" 1175.7 kJ·mol-1
H1="+" 1175.7 kJ·mol-1 PtF6(g)+ e-1
PtF6(g)+ e-1 PtF6-(g)
PtF6-(g) H2=" -" 771.1 kJ·mol-1
H2=" -" 771.1 kJ·mol-1 O2+PtF6-(s)=O2+(g)+PtF6-
O2+PtF6-(s)=O2+(g)+PtF6- 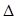 H3="+482.2" kJ·mol-1
H3="+482.2" kJ·mol-1 则反应O2(g)+ PtF6 (g) = O2+PtF6- (s)的
则反应O2(g)+ PtF6 (g) = O2+PtF6- (s)的 H="_____________" kJ·mol-1。
H="_____________" kJ·mol-1。 (3)在25℃下,向浓度均为0.1 mol·L-1的MgCL2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCL2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。 (4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4*)=c(Cl-),则溶液显_____________性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=__________。
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4*)=c(Cl-),则溶液显_____________性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=__________。