工业上制取硝酸铵的流程图如下,请回答下列问题:
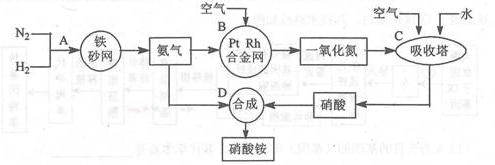
(1)合成氨的工业设备名称是 ,设备中设置热交换器的目的的是________;此生产过程中,N2与H2合成NH3所用的催化剂是____ ;生产中原料气必须进行脱硫,目的是____ 。
(2)吸收塔中反应为 ,从生产流程看,吸收塔中需要补充空气,其原因是 。
(3)生产硝酸的过程中常会发生一些氮的氧化物,可用如下三种方法处理:
方法一:碱吸收法:
NO+NO2+2NaOH=2NaNO2+H2O,2NO2+Na2CO3=NaNO2+NaNO3+CO2
方法二:氨还原法:
8NH3+6NO2=7N2+12H2O(该反应放热,NO也有类似的反应)
方法三:甲烷吸收法:
CH4(g)+2NO2(g)=CO2(g)+N2(g)+2H2O(g) △H=+867kJ·mol-1(NO也有类似的反应)
上述三种方法中方法一最大的缺点是____;方法三和方法二相比,优点是________,缺点是_____________。
(4)某化肥厂用NH3制备NH4NO3。已知:由NH3制NO的产率是94%,NO制HNO3的产率是89%,则制HNO3所用的NH3的质量占总耗NH3质量(不考虑其他损耗)的 %(保留三位有效数值)。
卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+和Mn2+等杂质离子。以卤块为原料按下图所示流程进行生产,可制得轻质氧化镁。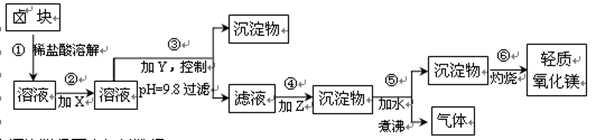
查阅资料得下表相关数据:
| 表1: 生成氢氧化物沉淀的pH |
表2: 原料价格表 |
|||
| 物质 |
开始沉淀 |
沉淀完全 |
物质 |
价格(元/吨) |
| Fe(OH)3 |
2.7 |
3.7 |
a.漂液(含25.2%NaClO) |
450 |
| Fe(OH)2 |
7.6 |
9.6﹡ |
b.双氧水(含30%H2O2) |
2400 |
| Mn(OH)2 |
8.3 |
9.8 |
c.烧碱(含98%NaOH) |
2100 |
| Mg(OH)2 |
9.6 |
11.1 |
d.纯碱(含99.5%Na2CO3) |
600 |
﹡Fe2+氢氧化物呈絮状,不易从溶液中除去,必须将它氧化后以Fe(OH)3沉淀形式才能除尽。
若要求产品尽量不含杂质且生产成本较低,请根据上表提供的资料回答:
(1)流程中加入的试剂X、Y、Z最佳选择依次是表2中的(选填试剂编号)。
(2)步骤②发生反应的离子方程式为;步骤⑤中发生反应的化学方程为。
(3)步骤③控制pH=9.8的目的是。
(4) 若在实验室进行步骤⑥的灼烧实验,必须用到的仪器是铁三脚、酒精喷灯、和
泥三角。
(5)在探究Mg(OH)2溶解性的实验中,发现向装有少量Mg(OH)2浊液的试管中加入适量
NH4Cl晶体,充分振荡后溶液会变澄清,请用化学平衡的原理解释浊液变澄清的原
因。
汽车尾气是城市空气的主要污染物之一,其主要有害成分是CO、氮氧化物(NOx)等。
(1)NOx产生的原因之一是汽车发动机工作时引发N2和O2反应,其能量变化值如右图所示,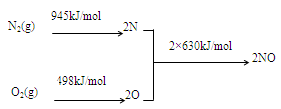
则:N2(g)+O2(g) 2NO(g)△H= 。
2NO(g)△H= 。
(2)汽车尾气中CO、NOx的有效消除成为环保领域的重要课题。某研究小组在实验室用某新型催化剂对CO、NO催化转化进行研究,测得NO转化为N2的转化率随温度、CO混存量的变化情况如下图一。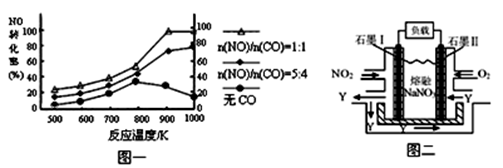
① NO与CO混存时,相互反应的化学方程式为。
② 1000K,n(NO)/n(CO)=5:4时,NO的转化率为75%,则CO的转化率约为。
③ 由于n(NO)/n(CO)在实际过程中是不断变化的,保证NO转化率较高的措施是将温度大约控制在K之间。
(3)汽车尾气中NOx有望通过燃料电池实现转化。已经有人以 NO2、O2和熔融NaNO3制成了燃料电池,其原理如图二。
① 图中石墨Ⅱ为电池的极。
② 在该电池使用过程中,石墨I电极上的产物是氧化物Y,其电极反应式为。
(4)甲醇也可用于燃料电池。工业上采用反应CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH<0合成甲醇。
CH3OH(g)+H2O(g) ΔH<0合成甲醇。
① 在恒容密闭反应器中,H2的平衡转化率与温度、压强的关
系如图三所示,则A、B、C三点处对应平衡常数(KA、KB、KC)的
大小关系为。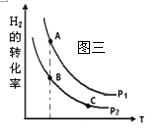
② 某高温下,将6molCO2和8molH2充入2L密闭容器中发生
反应,达到平衡后测得c(CO2)=2.0mol·L-1,则该温度下反应的平
衡常数值为。
化合物E能制解热镇痛药。以苯酚为原料的工业合成路线(部分)如下图:
已知, ,请填写下列空格:
,请填写下列空格:
(1)反应①、②的反应类型 、 ;E的分子式 。
(2)A的结构简式 ,分子中官能团的名称 。
(3)向C溶液中加入少量浓溴水,发生反应的化学方程式 。
D与足量NaOH溶液共热时,发生反应的化学方程式 。
(4)可选用下列试剂中的 (填编号)来鉴别D和B的水溶液。
| A.FeCl3溶液 | B.FeSO4溶液 | C.NaHCO3溶液 | D.NaOH溶液 |
(5)写出一种满足下列三项条件的B的同分异构体的结构简式
①是一种芳香族化合物,②属α-氨基酸,③苯环上有4种不同环境的氢原子。
氯化亚铜(CuCl)是有机合成工业中应用较广泛的催化剂,它是白色粉末,微溶于水,不溶于乙醇,在空气中会被迅速氧化。从酸性电镀废液(主要含Cu2+、Fe3+)中制备氯化亚铜的工艺流程如下:

请回答下列问题:
(1)电镀污泥的主要成分是(写化学式)。
(2)铁粉、氯化钠、硫酸铜在溶液中反应生成CuCl的离子反应方程式为:
。
(3)析出CuCl晶体时的最佳pH在左右。
(4)析出的CuCl晶体要立即用无水乙醇洗涤,然后真空干燥、冷却,密封包装。真空干燥,密封包装的目的是。
(5)从滤液A中可回收的主要物质是(写化学式)。
(6)以碳棒为电极电解CuCl2溶液可得到CuCl。写出电解CuCl2溶液后的阴极上发生的反应为
汽车尾气中的CO、NOX已经成为大气的主要污染物,使用稀土等催化剂能将CO、NOX、碳氢化合物转化成无毒物质,从而减少汽车尾气污染。
(1)已知:N2(g)+O2(g)=2NO(g) △H1①
2C(s)+O2(g)=2CO(g) △H2②
C(s)+O2(g)=CO2(g) △H3③
写出NO与CO催化转化成N2和CO2的热化学方程式(反应热用△H1、△H2、△H3表示):。
(2)在容积相同的两个密闭容器内(装有等量的某种催化剂),分别充入同量的NOx及C3H6,在不同温度下,同时发生以下反应:
18NO(g)+2C3H6(g) 9N2(g)+6CO2(g)+6H2O(g);
9N2(g)+6CO2(g)+6H2O(g);
18NO2(g)+4C3H6(g) 9N2(g)+12CO2(g)+12H2O(g);
9N2(g)+12CO2(g)+12H2O(g);
并分别在t秒时测定其中NOX的转化率,绘得图像如下图所示:
① 从图中可以得出的结论是
结论一:相同温度下,。
结论二:。
② 上述NO2和C3H6反应达平衡后,可提高NO2
转化率的措施有。(填编号)
| A.加入催化剂 | B.降低温度 |
| C.分离出H2O(g) | D.增大压强 |
(3)CO的中毒是由于CO与血液中血红蛋白的血红素
部分反应生成碳氧血红蛋白(Hb·CO),在37℃时:CO+Hb·O2 O2+Hb·CO K=220
O2+Hb·CO K=220
实验表明,Hb·CO的浓度即使只有Hb·O2浓度的2%,也可造成人的智力损伤。抽烟后,测得平衡时人体肺部的空气中CO和O2的浓度分别为10-6 mol·L-1和10-2 mol·L-1。请问,抽烟会造成人的智力损伤吗?(写出计算过程)