氮及其化合物在工农业生产、生活中有着重要作用。
(1)下图1是1molNO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式____
(2)在固定容积的密闭容器中,进行如下化学反应:N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ·mol-1 用一定物质的量的N2和H2合成NH3,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其它条件相同的情况下,实验测得反应均进行到t min时NH3的质量分数如右图所示
2NH3(g) △H=-92.4kJ·mol-1 用一定物质的量的N2和H2合成NH3,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其它条件相同的情况下,实验测得反应均进行到t min时NH3的质量分数如右图所示

此时甲、乙、丙三个容器中一定达到化学平衡状态的是 ,都达到平衡状态时,NH3的质量分数最高的是____ 。
下图2是实验室在三个不同条件的密闭容器中,分别加入浓度均为c(N2)="0.10" mol/L,c(H2) =" 0.26" mol/L进行反应时,N2的浓度随时间的变化如下图①、②、③曲线所示。

I.该反应实验②平衡时H2的转化率为 。
II.据图2所示,②装置中有一个条件与①不同。请指出②相对①改变的条件 。
III.计算实验③的平衡常数为___________________。
(3)最近美国Simons等科学家发明了使NH3直接用于燃料电池的方法,其装置用铂黑作电极、加入碱性电解质溶液中,一个电极通入空气,另一电极通入NH3.其电池反应生成一种单质和一种化合物,写出负极的电极反应式 。
(4)铜与一定浓度硝酸反应时方程式可表示为:Cu+HNO3一Cu(NO3)2+NO +NO2 +H2O(方程式未配平)。3.2 g Cu被硝酸完全溶解后,如果得到的NO和NO2物质的量相同,则得到标准状况下NO体积为_______ L。
【化学—有机化学基础】
已知由C、H、O三种元素组成的化合物A,其相对分子质量为60,且A能与NaHCO3反应生成CO2;有机物B与A相对分子质量相同,A和B之间能发生酯化反应,生成有机物C;B烃基上的一氯取代产物有3种。请回答下列问题:
(1)C的结构简式是 ______________________;
(2)有机物B在Cu作催化剂的条件下与O2 反应生成D,有机物E是D的氧化产物,F是E的一种同分异构体,F可发生如下图所示的转化,其中Y的分子式为C6H8O4且分子中含有一个由六个原子构成的环。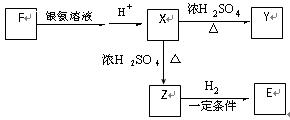
①写出F的结构简式_____________________;
②写出由X生成Y的化学方程式________________________________________;
③Z在一定条件下可以聚合生成高分子化合物,写出化学方程式 。
【化学—物质结构与性质】
第四周期的Cr 、Fe、Co、Ni、Cu、Zn等许多金属能形成配合物。
、Fe、Co、Ni、Cu、Zn等许多金属能形成配合物。
(1)Cr的核外电子排布式为 ;
(2)科学家通过X射线测得胆矾结构示意图可简单表示如下: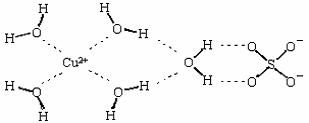
图中虚线表示的作用力为 ;
(3)胆矾溶液与氨水在一定条件下可以生成Cu(NH3)4SO4·H2O晶体。在Cu(NH3)4SO4·H2O晶体中,[Cu(NH3)4]2+为平面正方形结构,则呈正四面体结构的原子团是 ,其中心原子的杂化轨道类型是 ;
(4)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈正四面体构型。试推测四羰基镍的晶体类型是 , Ni(CO)4易溶于下列 。
| A.水 | B.四氯化碳 | C.苯 | D.硫酸镍溶液 |
【化学—化学与技术】
硫酸工业生产应考虑综合经济效益问题。
(1)若从下列四个城市中选择一处新建一座硫酸厂,你认为厂址宜选在 的郊区(填标号);
A.有丰富黄铁矿资源的城市 B.风光秀丽的旅游城市
C.消耗硫酸甚多的工业城市 D.人口稠密的文化、商业中心城市
(2)CuFeS2 是黄铁矿的另一成分,煅烧时CuFeS2 转化为CuO、Fe2O3和SO2,该反应的化学方程式为 。
(3)在硫酸工业制法中,下列生产操作与说明生产操作的主要原因二者都是正确的是 。
A.黄铁矿燃烧前需要粉碎,因为大块的黄铁矿不能在空气中燃烧
B.从沸腾炉出来的炉气需净化,因为炉气中二氧化硫会与杂质反应
C.二氧化硫氧化为三氧化硫时需使用催化剂,这样可以提高二氧化硫的转化率
D.三氧化硫用98.3%的浓硫酸吸收,目的是防止形成酸雾,以提高三氧化硫的吸收效率
(4)由硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO与SO3在沸腾炉中化合而 成),其中硫酸铜的质量分数随沸腾炉温度不同而变化(见下表)
成),其中硫酸铜的质量分数随沸腾炉温度不同而变化(见下表)
| 沸腾炉温度/℃ |
600 |
620 |
640 |
660 |
| 炉渣中CuSO4的质量分数/% |
9.3 |
9.2 |
9.0 |
8.4 |
已知CuSO4在低于660℃时不会分解,请简要分析上表中CuSO4 的质量分数随温度升高而降低的原因 。
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
(1)用CH4 催化还原NOx 可以消除氮氧化物的污染。例如:
CH4(g) + 4NO2(g) = 4NO(g)+CO2(g) + 2H2O(g)ΔH1=-574 kJ·mol-1
CH4(g) + 4NO(g) =" 2" N2(g)+CO2(g) + 2H2O(g)ΔH2
若1 mol CH4 还原NO2 至N2,整个过程中放出的热量为867 kJ,则ΔH2= ;
(2)工业合成氨气需要的反应条件非常高且产量低,而一些科学家采用高质子导电性的SCY陶瓷(能传递H+)实现氨的电化学合成,从而大大提高了氮气和氢气的转化率。电化学合成氨过程的总反应式为: +3
+3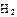
 2
2 ,则在电化学合成氨的过程中,阴极反应式为_________;
,则在电化学合成氨的过程中,阴极反应式为_________;
(3)在一定条件下,将l mol N2 与3 mol H2 混合于一个10 L密闭容器中,反应达到平衡时,A点混合气体中氨占25%,试回答:
①N2的转化率为 ;
②右图中在状态A时,平衡常数KA (填写代入数值的表达式,不要求算出具体数值);当温度由T1变化到T2时,KA KB(填“>”、“<”或“=”)。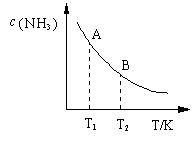
③在容积固定的密闭容器中发生上述反应,各 物质的浓度如下表:
物质的浓度如下表:
反应从0 min到3 min之间,H2的反应速率为 ;反应在3 min时,条件发生了改变,改变的条件可能是 (填序号)。
a.使用催化剂 b.降低温度 c.增加H2的浓度
现有A、B、C、D、E五种短周期元素,已知他们的原子序数依次增大,元素A的原子只有一个电子层;又知元素A能分别与元素B、C、D形成电子总数相等的化合物分子X、Y、Z,Y有刺激性气味,Z常温下为液态,元素E的单质的水溶液有漂白性。
请回答下列问题:
(1)元素E的单质的饱和溶液与石灰石反应后所得溶液的漂白性增强的原因是 ;
(2)在锅炉水中加入C2A4,可以把锅炉表面的氧化铁还原为结构紧密的四氧化三铁保护层,C2A4被氧化,且反应中无污染物生成,写出反应的化学方程式(不必配平) ,1 mol C2A4参加反应转移电子的数目为 ,氧化产物的化学式为 ;
(3)化合物Y与元素C的最高正价氧化物的水化物按物质的量比为2:1完全反应后的水溶液呈 性(填“酸”“碱”或“中”),溶液中离子浓度由大到小的顺序为 ;
(4)用X、D2 和能传导O2-的的固体电解质组成的原电池中,负极的电极反应式为 。
(5)A、B、D三种元素可以形成最简式为B2A4D且有香味的有机物,该有机物在酸性条件下可以水解,生成含碳原子数相同的两种常见有机物,这两种有机物均可用作食品调味剂。则这种有香味的有机物在一定条件下水解的化学方程式是 。