草酸钴用途广泛,可用于指示剂和催化剂的制备。一种利用水钻矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4.2H2O工艺流程如下:
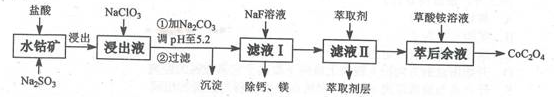
己知:,①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Co(OH)2 |
Al(OH)3 |
Mn(OH)2 |
| 完全沉淀的pH |
3.7 |
9.6 |
9.2 |
5.2 |
9.8 |
(1)浸出过程中加入Na2SO3的目的是 。
(2)将氯气通入到热的浓氢氧化钠溶液可以来制取NaClO3,请写出该反应的离子方程式为______________;实验需要制取10.65克NaClO3,需要的氯气由电解食盐水生成,若不考虑反应过程中的损失,则同时生成的氢气的体积为____ .(标准状况下)。
(3)萃取剂对金属离子的萃取率与pH的关系 ,如图所示。滤液II中加入萃取剂的作用是 ;使用萃取剂最适宜的pH是 (填选项序号)。
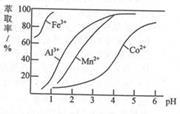
A.接近2.0
B.接近3.0
C.接近5.0
(4)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11,Ksp(CaF2)=1.05×10-1。当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+)=________
(5)为测定制得的无水草酸钴样品的纯度,现称取样品mg,先用适当试剂将其转化,得到纯净的草酸铵溶液,再用过量的稀硫酸酸化,用c mol/L高锰酸钾溶液去滴定,当溶液由 时(填颜色变化),共用去高锰酸钾溶液V mL,计算草酸钴样品的纯度为 。
(6)浓度均为0.l mol/L的Na2SO3和Na2CO3的混合溶液中,SO32-、CO32-、HSO3-、HCO3-浓度从大到小的顺序为
已知:H2SO3 Ka1=1.54×10-2 Ka2=1.02×10-7
H2CO3 Ka1=4.3×10-7 Ka2=5.6×10-11
(1)9.03×1023个CO2的物质的量是,质量是g,在标准状况下的体积为L,其中含有个氧原子。
(2)在100mL2mol/LH2SO4溶液中,H2SO4的质量是,H+的物质的量浓度为。
(3)质量分数为36.5%、密度为1.18g/cm3的浓盐酸中HCl的物质的量浓度为。
钠、氯及其化合物有如下转化关系,请按要求填空: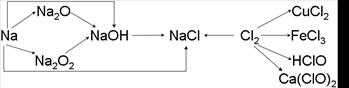
(1)金属钠的密度比水,实验室中金属钠通常保存在中。金属钠投入水中,剧烈反应,反应的化学方程式为。
(2)Na2O2 是色的固体,Na2O2 可用于呼吸面具作氧气的来源,有关反应的化学方程式为。
(3)通常情况下,为了防止Cl2污染环境,在做完实验后,多余的氯气应用NaOH溶液吸收,其化学方程式为。若NaOH溶液吸收了33.6L(标况) Cl2反应转移的电子的数目为。
(4)将新制氯水滴入AgNO3溶液中,观察到现象,原因是。将红色布条投到新制氯水中,观察到红色布条退色,原因是。
有机化学反应因反应条件不同,可生成不同的有机产品。例如:
HX +  (X为卤素原子)
(X为卤素原子)
工业上利用上述信息,按下列路线合成结构简式为 的物质,该物质是一种香料。
的物质,该物质是一种香料。
请根据上述路线,回答下列问题:
(1)A的结构简式可能为____________________________________。
(2)反应①、③、⑤的反应类型分别为________、________、_______。
(3)反应④的化学方程式为(有机物写结构简式,并注明反应条件):_______________________。
(4)工业生产中,中间产物A须经反应③④⑤得D,而不采取直接转化为D的方法,其原因是________ _______________________________。
(5)这种香料具有多种同分异构体,其中某些物质有下列特征:①其水溶液遇FeCl3溶液呈紫色 ②分
子中有苯环,且苯环上的一溴代物有两种。写出符合上述条件的物质可能的结构简式(只写两种):
_____________________________,_______________________________。
(16分)已知一个碳原子连两个—OH的结构不稳定,会很快脱去一分子水,其变化如下: →
→ +H2O
+H2O
下图中B和 、
、 等都是A和Cl2发生反应生成的产物,E是一种高分子化合物,透光性能好,常用作一些灯饰外壳。过程中一些小分子都已经略去。
等都是A和Cl2发生反应生成的产物,E是一种高分子化合物,透光性能好,常用作一些灯饰外壳。过程中一些小分子都已经略去。
(1)A的化学名称为___ _
(2)第④步的化学方程式为__________,该反应类型为_____;
(3)第⑦步的化学方程式为__________,该反应类型为_____;
(4)E的结构简式为______;
(5)符合下列条件:苯环上有两个取代基且苯环上只有两种不同化学环境的氢的C的同分异构体的结构
简式分别是、、。
(每空2分,共14分)已知将盐酸滴入高锰酸钾溶液中,产生黄绿色气体(Cl2),而溶液的紫红色褪去。现有一个氧化还原反应的体系中,共有KCl、Cl2、H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质:
(1)该反应中,化合价升高的反应物是_____,化合价没有发生变化的反应物是______。
(2)该反应中,发生还原反应的过程是(填化学式)___________→____________ 。
(3)上述反应中, 1 mol氧化剂在反应中______(填“得到”或“失去”) ____ mol电子。
(4)如果在反应后的溶液中加入NaBiO3,溶液又变紫红色,说出NaBiO3的一个化学性质:。