【化学——选修3物质结构与性质】原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期,自然界中存在多种A的化合物,B原子核外电子有6种不同的运动状态,B与D可形成正四面体形分子,C元素原子的最外层有3个自旋方向相同的未成对电子,E的基态原子的最外能层只有一个电子,其他能层均已充满电子。
请回答下列问题:
(1)这四种元素中电负性最大的元素,其基态原子的价电子排布图为 。
(2)D所在主族的前四种元素分别与A形成的化合物,沸点由高到低的顺序是 (填化学式),呈现如此递变规律的原因是 。
(3)B的气态氢化物分子呈 形。该分子的中心原子的杂化方式为 。A与C形成CA3型分子,分子中C原子的杂化类型为 ,分子的立体结构为 ;C的单质与化合物BD是等电子体,根据等电子体原理,写出化合物BD的电子式 。
(4)B元素可形成多种单质,一种晶体结构如图一所示;另一种的晶胞如图二所示,该晶胞的空间利用率为 (保留两位有效数字)。(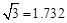 )
)
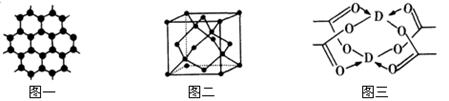
(5)E元素形成的单质,其晶体的堆积模型为 ,E的醋酸盐晶体局部结构如图三,该晶体中含有的化学键是 (填选项序号)。
①极性键 ②非极性键 ③配位键 ④金属键
(6)向E的硫酸盐溶液中滴加过量氨水,观察到的现象是 。请写出上述过程的离子方程式 。
(12 分)在一定条件下,向体积为2 L的容器中加入2 mol O2和3 mo
分)在一定条件下,向体积为2 L的容器中加入2 mol O2和3 mo l SO2进行可逆反应:2SO2(g)+ O2(g)
l SO2进行可逆反应:2SO2(g)+ O2(g) 2SO3(g),2 min后测得O2的物质的量为1.6 mol,则:
2SO3(g),2 min后测得O2的物质的量为1.6 mol,则:
(1)2 min内,SO2的物质的量减少了mol,SO3的物质的量增加了mol;
(2)若用O2的浓度变化来表示该反应的反应速率,则V(O2)=;
(3)若用SO3的浓度变化来表示该反应的反应速率,则V(SO3)=。
下列是元素周期表的前三周期中的部分元素:
族周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 一 |
H |
He |
||||||
| 二 |
Li |
C |
N |
O |
F |
|||
| 三 |
Na |
Mg |
S |
Cl |
(1)这些元素中,最活泼的元素是,最不活泼的元素是;
(2)原子结构示意图 所表示的原子是。其单质最硬的元素为。
所表示的原子是。其单质最硬的元素为。
(3)Na和Mg两种元素的最高价氧化物对应的水化物都是碱,则这两种碱的碱性强弱为NaOHMg(OH)2 (填“大于”或“小于”);
(4)请写出由上表第三周期元素形成的一种离子化合物的化学式。
芬必得是一种解热、镇痛及抗生素药物的商品名,其主要成分是化合物对异丁基-α-甲基苯乙酸,药名为布洛芬,它有多种合成路线,其中一种的合成路线如下: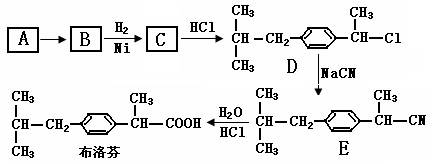
(1)由A生成B反应方程式是: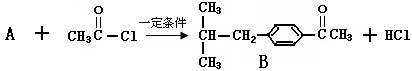
有机物A的结构简式是,该反应的类型是。
(2)由B生成C反应方程式是,反应类型是。
(3)有机物D的官能团是。
(4)根据布洛芬的结构,下列判断不正确的是(填序号)。
| A.能与NaOH溶液反应 | B.苯甲酸的同系物 |
| C.能与溴水发生加成反应使溴水褪色 | D.能使酸性高锰酸钾溶液褪色 |
E.不能发生取代反应 F.1mol布洛芬能与1mol金属钠反应
PET是世界上产量最大的合成纤维。其结构简式为: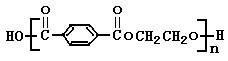
有人以石油产品对二甲苯和最简单的烯烃D为原料,设计合成PET的工业生产流程如下图所示(反应中部分无机反应物及产物未列出)。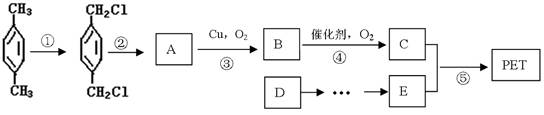
请回答下列问题:
(1)发生反应①时,需加入的反应物及反应条件是、。发生反应②时,需加入的反应物及反应条件是、。
(2)有机物A有多种同分异构体,写出满足下列条件的A的一种同分异构体X的结构简式。
①在X中滴入FeCl3溶液,溶液呈紫色;②X的分子结构中只有一个甲基;③1molX分别与足量的金属钠、NaOH溶液反应,消耗n(Na):n(NaOH)=2:1。
(3)写出反应⑤的化学方程式,其反应类型是。
(4)从D到E,工业上一般通过二步反应来完成。有人从原子利用率100%的角度提出通过D与某无机物一步合成E,该无机物的化学式是。
A是一种含碳、氢、氧三种元素的有机化合物,已知:A相对分子质量为144,其中碳的质量分数为50%。A具有如下性质:①可以使溴水褪色。②难溶于水。③在酸性条件下1molA发生水解反应,得到1molB和2mol甲醇。
(1)A可以发生的反应有(选填编号)
①加成反应②酯化反应③加聚反应④氧化反应
(2)B分子所含官能团的名称是、。
(3)与B具有相同官能团的同分异构体的结构简式是 ____。
(4)由B制取A的化学方程式是:。