某校化学小组对热水壶底部水垢的主要成分进行了如下探究,请完成以下活动并回答相关问题。
【查阅资料】
天然水中含有Ca2+、Mg2+、HCO3-等离子,在加热条件下,这些离子趋于生成溶解度更小的物质——水垢(主要成分为碳酸盐和碱)。有关物质的溶解性见下表(20℃):
| 阴离子 阳离子 |
OH- |
CO32- |
HCO3- |
| Ca2+ |
微溶 |
不溶 |
可溶 |
| Mg2+ |
不溶 |
微溶 |
可溶 |
根据上述物质的溶解性,小组同学确定水垢的主要成分中一定含有的两种物质是 ,可能含有Ca(OH)2和MgCO3。
【提出问题】水垢的主要成分中是否含有Ca(OH)2和MgCO3呢?
【实验方案1】确定水垢中是否含Ca(OH)2
| 实验步骤 |
实验现象 |
结论 |
| 在少量研碎的水垢中,加入适量的蒸馏水充分搅拌,过滤,在滤液里加入Na2CO3溶液。 |
_______________ |
水垢中无Ca(OH)2 |
【实验方案2】确定水垢中是否含MgCO3
利用下列实验装置,完成实验2探究。其主要实验步骤如下: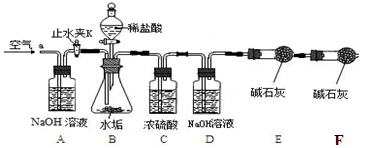
按上图组装后,将9.8g水垢试样放入锥形瓶中,打开止水夹K,从导管a处缓缓鼓入空气,一段时间后精确称量D、E装置总质量为600.0g关闭止水夹K,加入足量稀盐酸溶液,待锥形瓶中不再产生气泡时,打开止水夹K,从导管a处再次缓缓鼓入空气,一段时间后称量装置D、E的总质量为604.4g(注意:碱石灰主要成分为CaO和NaOH的混合物)。
【实验讨论】
(1)加入药品前应 ;待锥形瓶中不再产生气泡时,打开止水夹K,缓缓鼓入空气的目的是 。
(2)C装置的作用是: __ 。
(3)装置B中生成CO2的质量为 g。通过计算说明该水垢中 (填序号)含MgCO3。
A.一定 B.一定不 C.可能 D.无法确定
【实验方案3】定量探究水垢中氢氧化镁的质量分数
另取质量为9.8g的水垢试样,加入7.3%稀盐酸与之恰好完全反应,测得消耗稀盐酸110 g。结合以上数据和实验结论,计算水垢样品中氢氧化镁的质量分数(写出计算过程,结果保留1位小数)。
【反思】缺少F装置会使所测水垢样品中氢氧化镁的质量分数 _____________(填写“偏大”或“偏小”或“不变”)。
碱石灰是氧化钙和固体氢氧化钠的混合物,常用作干燥剂。它极易与空气中的水蒸气、二氧化碳反应而变质,因此在实验室里碱石灰应 保存。
实验室现有一瓶敞口放置的碱石灰,甲同学决定对其成分进行探究:
【猜想】猜想Ⅰ:未变质,样品中只含有氧化钙和氢氧化钠;
猜想Ⅱ:部分变质,样品中有氢氧化钙、碳酸钙和碳酸钠;
猜想Ⅲ:完全变质,样品中只含有碳酸钙和碳酸钠。
【资料】氯化钙溶液呈中性,碳酸钠溶液呈碱性。
【实验】设计如下流程进行实验:
步骤1:取少量碱石灰样品于烧杯中,加入足量的水,充分搅拌后过滤,得到滤渣和溶液M;
步骤2:向滤渣中滴加过量稀盐酸,产生气泡,得到溶液N;
步骤3:取少量溶液M于试管中,先滴加酚酞溶液,观察到溶液变成红色,再滴加过量氯化钙溶液,观察到 。
综合以上实验现象,证明猜想Ⅲ正确。
【拓展】乙同学取一定量的溶液N于烧杯中,向其中逐滴滴入溶液M,测得烧杯内溶液的pH与所加溶液M的质量的关系如图所示,则BC段发生反应的化学方程式为 。图中 (“A”“B”“C”或“D”)点对应的溶液中所含溶质种类最少。

实验室有一包白色固体,其成分为氢氧化钠、碳酸钠和氯化钠。某兴趣小组为测定固体中各成分的质量分数,进行了以下实验。
【探究一】测量样品与盐酸反应得到氯化钠的质量
如图1所示,取3.00g样品置入锥形瓶中,加适量水溶解。逐滴加入过量的稀盐酸,用pH传感器等电子设备采集信息形成图像。将锥形瓶中最终所得溶液蒸发、结晶得到全部固体,其质量为3.48g。

(1)a点溶液呈 (填“酸性”“碱性”或“中性”)。
(2)ab段溶液pH降低,发生反应的化学方程式为 (写一个即可)。
(3)蒸发时除使用蒸发皿、铁架台(带铁圈)外,还需要用到的仪器有 。
【探究二】测量样品与硫酸反应生成二氧化碳的体积
如图2所示,另取3.00g样品与足量稀硫酸混合,测得生成二氧化碳的体积为220mL(该条件下二氧化碳的密度为2.00g/L;装置气密性良好且忽略二氧化碳的溶解)。
(4)结合探究一计算出样品中氯化钠的质量分数为 (精确到0.1%)。
(5)下列因素会导致所测样品中氯化钠的质量分数偏小的是 (填标号)。
A.探究一中加入的稀盐酸量不足
B.探究一中蒸发时有液体溅出
C.探究二中俯视读取量筒中水的体积
D.探究二实验后生成气体在锥形瓶中仍有滞留
十堰某中学化学兴趣小组为鉴定某工厂排出的无色污水成分,他们查阅工厂的有关资料,推测出污水中可能含有盐酸、硫酸钠和氢氧化钠中的一种或几种物质,小组同学取污水进行了探究:
【查阅资料】硫酸钠溶液呈中性
【实验探究】
实验一:小组同学用pH试纸测得的污水的pH=2,由此得出污水中一定不含 ,原理是: (用化学方程式表示)。
实验二:为检测污水中可能含有的成分,甲同学做了如下实验:
|
实验操作 |
实验现象 |
实验结论 |
|
取少量污水于一支洁净试管中,向其中滴加少量的
|
有白色沉淀生成 |
污水中一定含有硫酸钠 |
实验二中生成白色沉淀的化学方程式为 。
【得出结论】兴趣小组确定了污水的成分。
【反思与评价】乙同学经过思考后,用物理方法也得到了甲同学的实验结论,他的实验操作及实验现象是: 。
兴趣小组同学在做镁与盐反应的实验时,不小心将镁条加到饱和的碳酸氢钠溶液中,意外发现溶液中有白色不溶物生成。同学们对白色不溶物的成分产生了浓厚兴趣,于是在老师的帮助下进行了如下的探究。

【提出问题】白色不溶物是什么物质?
【猜想与假设】
猜想①是Mg(OH)2
猜想②是MgCO3
猜想③是Mg(OH)2和MgCO3的混合物
【查阅资料】
1.MgCO3、Mg(OH)2加热易分解,分别生成两种氧化物。
2.白色无水硫酸铜遇水变蓝。
3.碱石灰是固体氢氧化钠和氧化钙的混合物。
【实验验证】取适量干燥的白色不溶物,充分加热,并使分解产生的气体依次通过如图1所示装置。
【实验现象】装置A中 ,装置B中 。
【实验结论】猜想③正确。请写出Mg(OH)2受热分解的化学方程式 。
【拓展探究】直接向白色不溶物中滴加足量 ,也能检验MgCO3的存在。
同学们为了进一步测定白色不溶物中各组分的质量关系,继续进行了下列探究。
称取干燥的白色不溶物36.8g,充分加热至不再产生气体,并使分解产生的气体全部被如图2所示装置C和D吸收。
【实验数据】实验后装置C增重3.6g,装置D增重13.2g。
【实验结论】若上述白色不溶物的组成用xMg(OH)2•yMgCO3表示,则x:y= 。
【反思评价】实验后,同学们经过讨论交流,发现实验方案可进一步优化,下列优化方案错误的是 (填序号)。
①只称量装置C、D增重的质量,不称量白色不溶物的质量
②去掉装置D,只称量白色不溶物和装置C增重的质量
③去掉装置C,只称量白色不溶物和装置D增重的质量
实验室有一瓶装满生石灰的塑料试剂瓶,已经膨胀破裂。初中化学兴趣小组的同学们对其成分产生浓厚兴趣,进行了如图实验探究:
【实验活动】

【初步结论】实验过程中没有温度变化,则该样品中没有 (填化学式)。
【提出问题】样品中究竟有哪些物质呢?同学们利用该固液混合物继续进行实验。
【进行实验】

【结论与解释】根据上述现象,同学们得出固体样品中有氢氧化钙和碳酸钙。你认为此结论 (填"正确"或"错误")。其中氢氧化钙产生的原因是 (用化学方程式表示)。
【深入交流】实验过程中细心的同学发现了这样的现象:边滴加稀盐酸边搅拌,溶液仍为红色时,固体表面没有气泡产生,但固体却减少了。针对此现象,同学们讨论后认为原因是:随着反应的进行,固体中的 继续与稀盐酸在溶液中反应,而未与碳酸钙反应。
【分析评价】同学们根据整个过程的实验现象,又绘制了溶液中某离子数目的变化趋势图。请你结合图像分析:

Ⅰ、该离子应该是 (填序号);
| A. |
①Ca 2+ |
| B. |
②OH ﹣ |
| C. |
③Cl ﹣ |
Ⅱ、在b→c的过程中,该离子数目减少的微观反应实质是: (用文字说明)。
老师对同学们认真严谨的科学态度给予了充分肯定,并鼓励他们可以尝试用更多的方法进行探究。