查尔酮类化合物是黄酮类药物的主要合成中间体。
(1)下列查尔酮类化合物I的说法正确的是 。
| A.加入溴的四氯化碳溶液,溶液褪色 |
| B.可发生加成或取代反应 |
| C.不与NaOH溶液发生反应 |
| D.加入新制的氢氧化铜有红色沉淀生成 |
(2)反应①是制取查尔酮类化合物的一种方法:
化合物III的分子式是 ,1mol化合物III最多能与 mol H2发生加成反应。
(3)化合物II可由化合物IV(分子式:C8H10O)在Cu催化氧化下制得,则化合物IV的结构简式为 ,化合物IV的一种同分异构体V为芳香族化合物,其核磁共振氢谱上有四组峰,峰面积之比为为1∶1∶2∶6,则V的结构简式为 (任写一种)。
(4)聚合物 是一种高分子材料,请利用类似反应①方法,用丙烯和丙醛为有机物原料合成该聚合物的单体。合成过程中涉及的反应方程式为 。
是一种高分子材料,请利用类似反应①方法,用丙烯和丙醛为有机物原料合成该聚合物的单体。合成过程中涉及的反应方程式为 。
酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是有碳粉,二氧化锰,氯化锌和氯化铵等组成的填充物,该电池在放电过程产生MnOOH,回收处理该废电池可以得到多种化工原料,有关数据下图所示:
溶解度/(g/100g水)
 温度/℃ 温度/℃化合物 |
0 |
20 |
40 |
60 |
80 |
100 |
| NH4Cl |
29.3 |
37.2 |
45.8 |
55.3 |
65.6 |
77.3 |
| ZnCl2 |
343 |
395 |
452 |
488 |
541 |
614 |
| 化合物 |
Zn(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
| Ksp近似值 |
10-17 |
10-17 |
10-39 |
回答下列问题:
(1)该电池的正极反应式为 ,电池反应的离子方程式为:
(2)维持电流强度为0.5A,电池工作五分钟,理论消耗Zng。(已经F=96500C/mol)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有氯化锌和氯化铵,两者可以通过____分离回收,滤渣的主要成分是二氧化锰、______和,欲从中得到较纯的二氧化锰,最简便的方法是,其原理是。
(4)用废电池的锌皮制作七水合硫酸锌,需去除少量杂质铁,其方法是:加入新硫酸和双氧水,溶解,铁变为加碱调节PH为,铁刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全)。继续加碱调节PH为 ,锌开始沉淀(假定Zn2+浓度为0.1mol/L)。若上述过程不加双氧水的后果是,原因是。
(12分)[化学---化学与技术]
工业上利用氨氧化获得的高浓度NOx气体(含NO、NO2)制备NaNO2、NaNO3,工艺流程如下: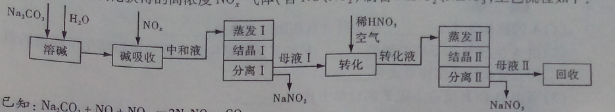
已知:Na2CO3+NO+NO2=2NaNO2+CO2
(1)中和液所含溶质除NaNO2及少量Na2CO3外,还有__________(填化学式)。
(2)中和液进行蒸发Ⅰ操作时,应控制水的蒸发量,避免浓度过大,目的是_______。蒸发Ⅰ产生的蒸气中含有少量的NaNO2等有毒物质,不能直接排放,将其冷凝后用于流程中的_______(填操作名称)最合理。
(3)母液Ⅰ进行转化时加入稀HNO3的目的是_______。母液Ⅱ需回收利用,下列处理方法合理的是________。
a.转入中和液 b.转入结晶Ⅰ操作 c.转入转化液 d.转入结晶Ⅱ操作
(4)若将NaNO2、NaNO3两种产品的物质的量之比设为2:1,则生产1.38吨NaNO2时,Na2CO3的理论用量为______吨(假定Na2CO3恰好完全反应)。
合金贮氢材料具有优异的吸收氢性能,在配合氢能的开发中起到重要作用。
(1)一定温度下,某贮氢合金(M)的贮氢过程如图所示,纵轴为平衡时氢气的压强(p),横轴表示固相中氢原子与金属原子的个数比(H/M)。
在OA段,氢溶解于M中形成固溶体MHx,随着氢气压强的增大,H/M逐惭增大;在AB段,MHx与氢气发生氢化反应生成氢化物MHy,氢化反应方程式为:zMHx(s)+H2(g)==ZMHy(s) △H(Ⅰ);在B点,氢化反应结束,进一步增大氢气压强,H/M几乎不变。反应(Ⅰ)中z=_____(用含x和y的代数式表示)。温度为T1时,2g某合金4min内吸收氢气240mL,吸氢速率v=______mL•g-1•min。反应的焓变△HⅠ_____0(填“>”“<”或“=”)。
(2)η表示单位质量贮氢合金在氢化反应阶段的最大吸氢量占其总吸氢量的比例,则温度为T1、T2时,η(T1)____ η(T2)(填“>”“<”或“=”)。当反应(Ⅰ)处于图中a点时,保持温度不变,向恒容体系中通入少量氢气,达到平衡后反应(Ⅰ)可能处于图中的_____点(填“b”“c”或“d”),该贮氢合金可通过______或_______的方式释放氢气。
(3)贮氢合金ThNi5可催化由CO、H2合成CH4的反应,温度为T时,该反应的热化学方程式为_________。已知温度为T时:CH4(g)+2H2O=CO2(g)+4H2(g)△H=+165KJ•mol
CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41KJ•mol
(15分)利用LiOH和钴氧化物可制备锂离子电池正极材料。LiOH可由电解法制备,钴氧化物可通过处理钴渣获得。
(1)利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。B极区电解液为__________溶液(填化学式),阳极电极反应式为__________ ,电解过程中Li+向_____电极迁移(填“A”或“B”)。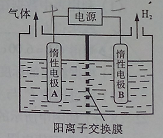
(2)利用钴渣[含Co(OH)3、Fe(OH)3等]制备钴氧化物的工艺流程如下: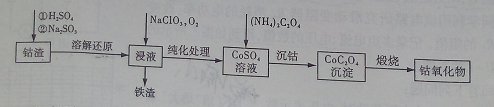
Co(OH)3溶解还原反应的离子方程式为____________________________________,铁渣中铁元素的化合价为___________,在空气中煅烧CoC2O4生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为1.344L(标准状况),则钴氧化物的化学式为__________。
海水是巨大的化学资源宝库。
Ⅰ.从海水中可以提取氯、溴、碘等卤族元素。
(1)HClO的电子式是 。
(2)已知:X2 (g)+H2(g) 2HX(g) (X2表示Cl2、Br2和I2)。
2HX(g) (X2表示Cl2、Br2和I2)。
下图表示平衡常数K与温度t的关系。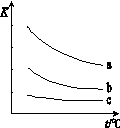
①ΔH 表示X2与H2反应的焓变,则ΔH 0(填“>”、“<”或“=”)。
②曲线a表示的是 (填“Cl2”、“Br2”或“I2”)与H2反应时K与t的关系。
Ⅱ.海水淡化具有广泛的应用前景,淡化前需对海水进行预处理。`
(1)通常用明矾[K2SO4·Al2(SO4)3·24H2O]作混凝剂,降低浊度。明矾水解的离子方程式是 。
(2)用下图所示NaClO的发生装置对海水进行消毒和灭藻处理。
①装置中由NaCl转化为NaClO的化学方程式是 , 。
②海水中含有Ca2+、Mg2+、HCO3-等杂质离子,处理过程中装置的阴极易产生水垢,其主要成分是Mg(OH)2和CaCO3。生成CaCO3的离子方程式是 。
③若每隔5-10 min倒换一次电极电性,可有效地解决阴极的结垢问题。试用电极反应式并结合必要的文字进行解释 。