海水是巨大的化学资源宝库。
Ⅰ.从海水中可以提取氯、溴、碘等卤族元素。
(1)HClO的电子式是 。
(2)已知:X2 (g)+H2(g) 2HX(g) (X2表示Cl2、Br2和I2)。
2HX(g) (X2表示Cl2、Br2和I2)。
下图表示平衡常数K与温度t的关系。
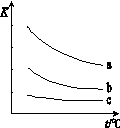
①ΔH 表示X2与H2反应的焓变,则ΔH 0(填“>”、“<”或“=”)。
②曲线a表示的是 (填“Cl2”、“Br2”或“I2”)与H2反应时K与t的关系。
Ⅱ.海水淡化具有广泛的应用前景,淡化前需对海水进行预处理。`
(1)通常用明矾[K2SO4·Al2(SO4)3·24H2O]作混凝剂,降低浊度。明矾水解的离子方程式是 。
(2)用下图所示NaClO的发生装置对海水进行消毒和灭藻处理。

①装置中由NaCl转化为NaClO的化学方程式是 , 。
②海水中含有Ca2+、Mg2+、HCO3-等杂质离子,处理过程中装置的阴极易产生水垢,其主要成分是Mg(OH)2和CaCO3。生成CaCO3的离子方程式是 。
③若每隔5-10 min倒换一次电极电性,可有效地解决阴极的结垢问题。试用电极反应式并结合必要的文字进行解释 。
(14分)某实验小组用下列装置进行乙醇催化氧化的实验。
(1)实验过程中铜网出现黑色和红色交替的现象,请写出相应的化学方程式
,。
在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇催化反应是
反应。
(2)甲和乙两个水浴作用不相同。甲的作用是;乙的作用是。
(3)反应进行一段时间后,试管a中能收集到不同的物质,它们是。集气瓶中收集到的气体的主要成分是。
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有
(填写字母)。
a.乙酸 b.苯 c.乙醇 d.乙醛
要除去该物质,可在混合液中加入 (填写字母)。
a.氯化钠溶液 b.乙醇 c.碳酸氢钠溶液 d.四氯化碳
氯气是一种有毒气体,但它是一种重要的化工原料,与我们的生活联系也比较密切。
(1)据新闻报道,前不久某地装运液氯的槽罐车发生交通事故,造成大量氯气泄漏,公路附近的村民被紧急疏散。请问:村民应该如何应变(填编号)。
| A.应躲到低洼的地方去 | B.可用烧碱溶液浸湿软布蒙面 |
| C.可用肥皂水或尿液浸湿软布蒙面 | D.应多饮水 |
E.应到较高的地方去
(2)实验室制取氯气的方法有很多种,其中之一是:KClO3+6HCl=KCl+3Cl2↑+3H2O。该反应中氧化剂是,还原剂是,当反应生成标准状况下6.72LCl2时,转移电子的物质的量为。
(3)日常生活环境可用稀的漂白液等进行消毒,请写出制漂白液的离子方程式
。
下图是某元素及其重要化合物之间的相互转化关系图(生成物中不含该元素的物质均已略去)。其中A是单质,D在常温下呈气态,F可用作氮肥。
据此,请回答下列问题:
(1)写出物质的化学式:A ,D ,F 。
(2)写出下列变化的化学方程式:
B→C 。
E→C 。
 化合物A相对分子质量为86,碳的质量分数为55.8%,氢为7.0%,其余为氧。A的相关反应如下图所示:
化合物A相对分子质量为86,碳的质量分数为55.8%,氢为7.0%,其余为氧。A的相关反应如下图所示:



 已知R-CH=CHOH(烯醇)不稳定,很快转化为R-CH2CHO。
已知R-CH=CHOH(烯醇)不稳定,很快转化为R-CH2CHO。
 根据以上信息回答下列问题:
根据以上信息回答下列问题:
 (1)A的分子式为;
(1)A的分子式为;
 (2)反应②的化学方程式是;
(2)反应②的化学方程式是;
 (3)A的结构简式是
(3)A的结构简式是
 ;(4)反应①的化学方程式是;
;(4)反应①的化学方程式是;
 (5)A的另一种同分异构体,其分子中所有碳原子在一条直线上,它的结构简式为。
(5)A的另一种同分异构体,其分子中所有碳原子在一条直线上,它的结构简式为。
.已知有机物分子中的烯键可发生臭氧分解反应,
例如:R-CH=CH-CH2OH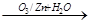 R-CH=O+O=CH-CH2OH。A的部分性质如图所示:
R-CH=O+O=CH-CH2OH。A的部分性质如图所示:
试根据上述信息结合所学知识写出A的结构简式。