能源、环境与人类生活和社会发展密切相关,研究它们的综合利用有重要意义。
(1)氧化还原法消除氮氧化物的转化如下:
①反应I为:NO+O3=NO2+O2,生成11.2 L O2(标准状况)时,转移电子的物质的量是 mol。
②反应II中,当n(NO2)∶n[CO(NH2)2]=3∶2时,反应的化学方程式是 。
(2)硝化法是一种古老的生产硫酸的方法,同时实现氮氧化物的循环转化,主要反应为:
NO2(g)+SO2(g) SO3(g)+NO(g) △H=-41.8 kJ·mol-1
SO3(g)+NO(g) △H=-41.8 kJ·mol-1
已知:2SO2(g)+O2(g) 2SO3(g) △H=-196.6 kJ·mol-1。
2SO3(g) △H=-196.6 kJ·mol-1。
写出NO和O2反应生成NO2的热化学方程 式 。
(3)将燃煤废气中的CO2转化为二甲醚的反应原理为:
2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g);该反应 平衡常数表达式为K= 。
CH3OCH3(g)+3H2O(g);该反应 平衡常数表达式为K= 。
(4)合成气CO和H2在一定条件下能发生如下反应:
CO(g) +2H2(g) CH3OH(g) △H<0。
CH3OH(g) △H<0。
在容积均为V L的I、II、III三个相同密闭容器中分别充入a mol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数υ(CO)%如图所示,
此时I、II、III三个容器中一定达到化学平衡状态的是 ;若三个容器内的反应再经过一段时间后都达到化学平衡时,CO转化率最大的反应温度是 。
(5)据报道以二氧化碳为原料,采用特殊的电极电解强酸性的二氧化碳水溶液可得到多种燃料,其原理如下图所示。电解时,b极上生成乙烯的电极反应式为___________________.
某工厂的废金属屑的主要成分为Cu、Fe和Al,此外还含有少量Al2O3和Fe2O3,该厂用上述废金属屑制取新型高效水处理剂Na2FeO4(高铁酸钠)等产品,过程如下:
Ⅰ.向废金属屑中加入过量的NaOH溶液,充分反应后过滤;
Ⅱ.向Ⅰ所得固体中加入过量稀H2SO4,充分反应后过滤;
Ⅲ.向Ⅱ所得固体中继续加入热的稀H2SO4,同时不断鼓入空气,固体溶解得CuSO4溶液;
Ⅳ.……
(1)步骤Ⅰ中发生反应的化学方程式为___________、______________。
(2)步骤Ⅱ所得的滤液中加入KSCN溶液无明显现象,表明滤液中不存在Fe3+,用离子方程式解释其可能的原因:__________。
(3)步骤Ⅲ获得CuSO4溶液的离子方程式为____________。
(4)步骤Ⅱ所得滤液经进一步处理可制得Na2FeO4,流程如下:
ⅰ.H2O2ⅱ.调pHNaClO/NaOH混合溶液
①测得滤液中c(Fe2+)为a mol·L-1,若要处理1 m3滤液,理论上需要消耗25%的H2O2溶液________kg(用含a的代数式表示)。
②写出由Fe(OH)3制取Na2FeO4的化学方程式:_____________。
A、B、C、D均为中学化学中常见的单质或化合物,它们之间的关系如图所示(部分产物已略去)。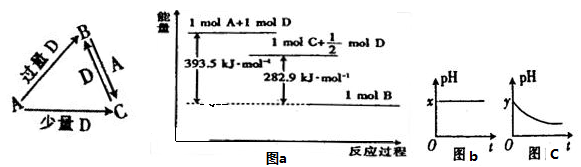
(1)若A为金属单质,D是某强酸的稀溶液,则反应C+D→B的离子方程式为;
(2)若A、B为盐,D为强碱,A的水溶液显酸性,则
①C的化学式为;
②反应B+A→C的离子方程式为;
(3)若A为强碱,D为气态氧化物。常温时,将B的水溶液露置于空气中,其pH随时间t变化可能如上图的图b或图c所示(不考虑D的溶解和水的挥发)。
①若图b符合事实,则D的化学式为;
②若图c符合事实,则其pH变化的原因是(用离子方程式表示);
(4)若A为非金属单质,D是空气的主要成分之一。它们之间转化时能量变化如上图a,请写出A+D→C的热化学方程式;
没食子酸丙酯简称PG,结构简式为 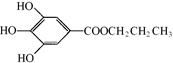 ,是白色粉末,难溶于水,微溶于棉子油等油脂,是常用的食用油抗氧化剂。
,是白色粉末,难溶于水,微溶于棉子油等油脂,是常用的食用油抗氧化剂。
⑴PG的分子式为,请写出PG分子中所含官能团的名称,1molPG与足量氢氧化钠溶液完全反应时,消耗的氢氧化钠的物质的量是。
PG可发生如下转化: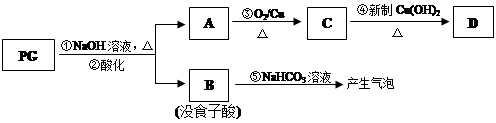
⑵A的结构简式为 ,1mol没食子酸最多可与mol H2加成。
⑶上图的有关变化中,属于氧化反应的有(填序号)。
⑷从分子结构或性质上看,PG具有抗氧化作用的主要原因是(填序号)。
| A.含有苯环 | B.含有羧基 | C.含有酚羟基 | D.微溶于食用油 |
⑸反应④的化学方程式为:
⑹B有多种同分异构体,写出其中符合下列要求的同分异构体的结构简式:
i.含有苯环,且苯环上的一溴代物只有一种;ii.既能发生银镜反应,又能发生水解反应。
近现代战争中,制造坦克战车最常用的装甲材料是经过轧制和热处理后的合金钢,热处理后整个装甲结构的化学和机械特性和最大限度的保持一致。钢中合金元素的百分比含量为:铬0.5~1.25镍0.5~1.5 钼0.3~0.6锰0.8~1.6碳0.3
(1)铬元素的基态原子的价电子层排布式是。
(2)C元素与其同主族下一周期元素组成的晶体中,C原子的杂化方式为 .
(3)Mn和Fe的部分电离能数据如表:
| 元素 |
Mn |
Fe |
|
| 电离能 /kJ·mol-1 |
I1 |
717 |
759 |
| I2 |
1509 |
1561 |
|
| I3 |
3248 |
2957 |
根据表数据,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是。
(4)镍(Ni)可形成多种配合物,且各种配合物有广泛的用途。
某镍配合物结构如右图所示,分子内含有的作用力
有(填序号)。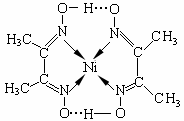
A.氢键 B.离子键 C.共价键 D.金属键 E.配位键
组成该配合物分子且同属第二周期元素的电负性由大到小的顺序是 。
(5)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈四面体构型。423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉。试推测:四羰基镍的晶体类型是
(6)铁能与氮形成一种磁性材料,其晶胞结构如右图所示,则该磁性材料的化学式为 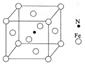
A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的最高价氧化物对应的水化物与其氢化物反应生成离子化合物;C单质一般保存在煤油中;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,G单质是日常生活中用量最大的金属,易被腐蚀或损坏。请回答下列问题: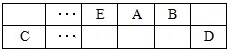
(1)A元素的氢化物水溶液能使酚酞变红的原因用电离方程式解释为。
(2)同温同压下,将a L A氢化物的气体和b L D的氢化物气体通入水中,若所得溶液的pH=7,则ab(填“>"或“<”或“=”)
(3)常温下,相同浓度F、G简单离子的溶液中滴加NaOH溶液,F、G两元素先后沉淀,F (OH)n完全沉淀的pH是4.7,G (OH)n完全沉淀的pH是2.8,则ksp较大的是:(填化学式)
(4)A与B可组成质量比为7:16的三原子分子,该分子释放在空气中其化学作用可能引发的后果有:。
①酸雨 ②温室效应 ③光化学烟雾 ④臭氧层破坏
(5)A和C组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是。
(6)已知一定量的E单质能在B2 (g)中燃烧,其可能的产物及能量关系如下左图所示:请写出一定条件下EB2(g) 与E(s)反应生成EB(g)的热化学方程式。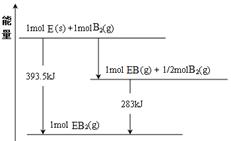
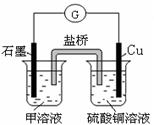
(7)若在D与G组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如上右图所示,其反应中正极反应式为。