乙酰水杨酸是一种使用广泛的解热镇痛剂。合成原理是:
(1)乙酰水杨酸的分子式为 ,1mol乙酰水杨酸最多能与 mol H2反应。
(2)上面反应的反应类型是 。
(3)有关水杨酸的说法,不正确的是 。
| A.能与溴水发生取代反应和加成反应 |
| B.可发生酯化反应和水解反应 |
| C.1mol水杨酸最多能与2mol NaOH反应 |
| D.遇 FeCl3溶液显紫色 |
(4)乙酰水杨酸与足量KOH溶液反应的化学方程式为 。
(5)乙酰氯(CH3COCl )也可以与水杨酸反应生成乙酰水杨酸,请写出化学反应方程式(不写条 件) 。
(6)写出一种符合下列条件的乙酰水杨酸的同分异构体的结构简式: 。
Ⅰ.能遇FeCl3溶液显色
Ⅱ.苯环上只有2种一溴取代物
Ⅲ.1mol该化合物能分别与含4mol Br2的溴水或4mol H2反应
尿素可作为H2O2的稳定载体,生产一种固态、耐储存、易运输的新型氧化剂和消毒剂—过氧化尿素[CO(NH2)2·H2O2],其合成工艺流程如下: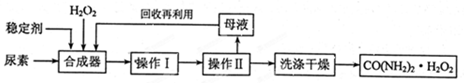
请回答下列问题:
(1)操作I、II的名称分别是______、_______。CO(NH2)2·H2O2分子中尿素和过氧化氢之间以________结合,其结合力较弱,具有尿素和过氧化氢双重性质。
(2)工业上生产尿素所需的原料气可由天然气与水反应制备,已知:
①甲烷、氢气的燃烧热分别为890.3KJ/mol、285.8kJ/mol
②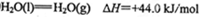
写出CH4与水蒸气作用生产CO2和H2的热化学方程式:_______________。
(3)合成过氧化氢尿素加入的稳定剂可以是水杨酸、酒石酸等。酒石酸分子式为C4H6O6,其核磁共振氢谱只有3种锋,只含羧基和羟基两种官能团,则酒石酸的结构简式为_____。
(4)为测定产品中H2O2的含量,称取干燥样品12.0g配成250mL溶液,取25.00mL
于锥形瓶中,加入适量硫酸酸化,用0.20mol/LKMnO4标准溶液滴定,三次滴定平均消耗KMnO4溶液20.00mL.(KMO4溶液与尿素不反应).
①完成并配平方程式: MnO4-+
MnO4-+  H2O2+
H2O2+  _________=Mn2++
_________=Mn2++ O2↑+
O2↑+ ___;
___;
②计算出产品中H2O2的质量分数为_______。
(5)电解尿素的废水既可以处理废水,又可制得纯氢,电解原理如图所示。电解池中隔膜仅阻止气体通过,B两极均为惰性电极。B极连接电源的____极(填
“正”或“负”),阳极电极反应方程为_____________。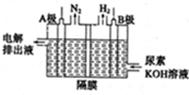
W、X、Y、Z是原子序数依次增大的短周期元素,它们中的两种或三种元素组成化合物甲、乙、丙、丁,几种物质的转化关系如图I所示。常温下0.01mol/L-1丙溶液
PH=12;XY2分子是非极性分子,但科学家在特殊条件下制得了XY2的原子晶体,其晶胞结构如图II所示。请回答下列问题: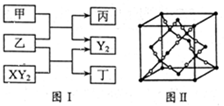
(1)甲与乙反应的化学方程式是______。
(2)甲的中心原子杂化轨道类型为_____;
XY2分子中, 键与π键的数目之比为_________;
键与π键的数目之比为_________;
XY2原子晶体的1个晶胞中含有_______个原子。
W、X、Y、Z四种元素电负性由大到小的顺序是_______(用元素符号表示)。
工业上用氯气与潮湿的丁反应制备次氯酸的酸酐(棕黄色气体),同时生成小苏打和食盐混合物,反应的化学方程式是______________________________。
元素周期表是学习化学的重要工具,它隐含着许多信息和规律,下面是八种短周期元素的相关信息(已知铍的原子半径为0.089nm)
| 元素代号 |
A |
B |
C |
D |
E |
| 原子半径/nm |
0.16 |
0.143 |
0.102 |
0.099 |
0.074 |
| 主要化合价 |
+2 |
+3 |
+6,-2 |
-1 |
-2 |
F原子中无中子,G最高正价数与负价数相等,且最外层电子数是次外层的二倍,H元素单质焰色反应呈黄色(用相应的元素符号完成下列空白)
(1)B元素在元素周期表中的位置___________________,上述八种元素的最高价氧化物对应的水化物中酸性最强的是__________,A离子的结构示意图_______________。
(2)用电子式表示A、D形成化合物的过程:____________________________________。H、E形成原子个数比为1:1的化合物的电子式为___________,含有的化学键类型为____________。C2D2的电子式为______________________。
(3)下列说法能说明D的非金属性比C强的选项____________
①H2CO4比HDO稳定②HDO4比H2CO4酸性强③C2-比D-易被氧化④HD比H2C稳定⑤铜与HD不反应,但能与浓H2CO4反应⑥铁与D2加热生成FeD3,铁与C加热生成FeC⑦C原子与D原子电子层数相同,D原子半径小于C原子。
A、全部 B、②③④⑥⑦ C、①②④⑤⑥ D、除①以外
(4)A、B、C、D、E形成的简单离子半径由大到小的顺序为_______________________。(用具体离子符号表示)
(5)C单质与H的最高价氧化物对应水化物在加热条件下能发生反应,若有3mol的C参与反应,转移4NA的电子,请写出离子反应方程_______________________________________,氧化剂与还原剂的质量之比_____________________。
(13分)有短周期元素A、B、C、D、E、F六种短周期元素,其原子序数依次增大。其中A是周期表中原子半径最小的元素,B的核外有两个电子层,其核外电子数为两层电子数之差的三倍;A、E和D、F分别同族。D的最外层电子数等于B的原子序数。试根据以上叙述回答:
(1)写出元素符号:C____________、D____________、E_____________、F_____________;
(2)写出由A、D、E、F四种元素组成的两种盐反应的离子方程式________________________;
(3)E单质点燃时生成的淡黄色固态化合物与水反应的化学方程式:______;
(4)A与C的最低价形成的化合物为M:
① 设计简单实验验证M的浓溶液的酸碱性________________________。(写出操作、现象和结论)
②写出M催化氧化的化学方程式_________________。
已知用NaAlO2制备α—Al(OH)3及能量转化关系如图: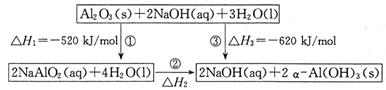
(1)反应②的热化学方程式为。
(2)根据上述能量转化关系,拜耳公司找到了一种简捷的从铝土矿获取Al2O3的方法,流程如下: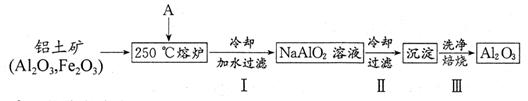
①物质A的化学式为;
②步骤Ⅲ的化学反应方程式为;检验步骤Ⅲ中沉淀是否洗净的方法是;
③步骤Ⅱ采用冷却的方法析出α—Al(OH)3,该措施的依据是;
④工业上可电解上述产物Al2O3以获得Al,若获得2.7kgAl,则理论上消耗A的物质的量至少为mol。有人提出用熔融Na[AlCl4]与NaCl的混合物代替Al2O3进行电解获得Al,则阴极反应为。