某工业废玻璃粉末含SiO2、Fe2O3、CeO2、FeO等。某课题小组设计如下工艺流程对资源进行回收,得到Ce(OH)4和硫酸铁铵矾。
已知:CeO2不溶于稀硫酸;酸性条件下,Ce3+易水解,Ce4+有较强氧化性。
(1)硫酸铁铵矾可净水,其原理是(写离子方程式) 。
(2)滤液A的主要成分 (填写化学式)。
(3)反应①的离子方程式是 。
(4)反应②的化学反应方程式是 。
(5)已知制硫酸铁铵矾晶体[Fe2(SO4) 3·(NH4) 2SO4·24H2O,式量964]的产率为80%,若加入13.2g (NH4) 2SO4(式量132),可制得晶体的质量是 。
(6)化合物HT可作为萃取剂能将铈离子从水溶液中萃取出来,过程表示为:
Ce2(SO4)3 (水层)+ 6HT(有机层) 2CeT3 (有机层)+3H2SO4(水层)
2CeT3 (有机层)+3H2SO4(水层)
分液得到CeT3 (有机层),再加入H2SO4 获得较纯的含Ce3+的水溶液。可选择硫酸作反萃取剂的原因是 (从平衡移动角度回答)。
向200mL 6mol·L-1盐酸中加入一定量的纯净CaCO3,产生气体的体积随时间的变化曲线如图所示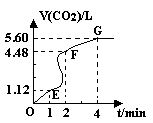 (气体体积均在标准状况下测定)。请回答下列问题:
(气体体积均在标准状况下测定)。请回答下列问题:
(1)设OE段的反应速率为v1,EF段的反应速率为v2,
FG段的反应速率为v3,则 影响v1、v2、v3反应速率的因素是;
(2)为了减缓上述反应的速率,欲向该溶液中加入下列物质,你认为可行的是(填字母)
| A.蒸馏水 | B.氯化钾固体 | C.氯化钠溶液 | D.浓盐酸 |
 (3)加入CaCO3的质量为。
(3)加入CaCO3的质量为。
(4)若反应过程中溶液体积的变化忽略不计,则EF段用盐酸表示的化学反应速率V(HCl)=______。
Ⅰ:某课外活动小组用如图装置进行实验,试回答下列问题。
(1)若开始时开关K与a连接,则B极的电极反应式为。
(2)若开始时开关K与b连接,则B极的电极反应式为
Ⅱ:下图A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。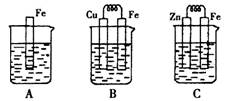
(3)B中若收集到224ml气体(标准状况),则溶解的金属质量为
(4)C中被腐蚀的金属是__________(填化学式),A、B、C中铁被腐蚀的速率,由快到慢的是顺序是_____________(用“>”表示)。
从能量的变化和反应的快慢等角度研究反应: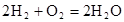 。
。
(1)为了加快正反应速率,可以采取的措施有________(填序号,下同)。
| A.使用催化剂 | B.提高氧气的浓度 |
| C.提高反应的温度 | D.降低反应的温度 |
(2)已知该反应为放热反应,下图能正确表示该反应中能量变化的是________。
(3)从断键和成键的角度分析上述反应中能量的变化。已知:化学键的键能:
| 化学键 |
H—H |
O=O |
H—O |
键能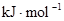 |
436 |
496 |
463 |
由此计算2molH2在氧气中燃烧生成气态水放出的热量
(4)已知1克氢气完全燃烧生成液态水放出QKJ的热量,则氢气燃烧生成液态水的热化学反应方程式为
(5)氢氧燃料电池的总反应方程式为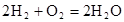 。其中,氢气在________(填“正”或“负”)极发生________反应(填“氧化”或“还原”)。电路中每转移0.2mol电子,标准状况下消耗H2的体积是________L。
。其中,氢气在________(填“正”或“负”)极发生________反应(填“氧化”或“还原”)。电路中每转移0.2mol电子,标准状况下消耗H2的体积是________L。
在某有机物A的分子中,其结构简式如下图。
(1)A跟NaOH溶液反应的化学方程式是
(2)A跟NaHCO3溶液反应的化学方程式是
(3)A在一定条件下跟Na反应的化学方程式是:
肉桂醛是一种食用香精,它广泛用于牙膏、洗涤剂、糖果以及调味品中。工业上可通过下列反应制备: +CH3CHO
+CH3CHO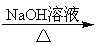
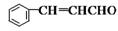 +H2O
+H2O
(1)请推测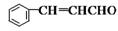 侧链上可能发生反应的类型:_______________、_________________。(任填两种)
侧链上可能发生反应的类型:_______________、_________________。(任填两种)
(2)请依据上述原理写出两分子乙醛在上述条件下反应的化学方程___________________________________。