某实验小组模拟“侯氏制碱法”制纯碱,并进行以下探究:
(1)检验纯碱样品中是否混有NaHCO3,请选择下列装置设计实验,并完成下表:
| 选择的装置 (填编号) |
实验现象 |
实验结论 |
| |
|
样品含 NaHCO3 |
(2)测定该纯碱样品的纯度:称取m1g样品,置于小烧杯中,加水溶解,滴加足量CaCl2溶液。将反应 混和物过滤、 (填操作)、干燥、称量为m2g。该纯碱样品的纯度为 。
(3)该小组同学在0.1mol/LNaHCO3溶液中滴加酚酞溶液1滴,溶液没有什么变化,但加热后显淡红色,加热较长时间后冷却,红色不褪去。为探究原因,进行了下列实验:
实验1:加热0.1mol/LNaHCO3溶液,测得溶液pH变化如下表
| 温度(℃) |
10 |
20 |
30 |
50 |
70 |
80 |
100 |
| pH |
8.3 |
8.4 |
8.5 |
8.9 |
9.4 |
9.6 |
10.1 |
但当温度恢复到10℃,测得溶液pH=9.8。
实验2:加热0.1mol/LNaHCO3溶液,将产生的气体通入澄清石灰水,澄清石灰水变浑浊。
①用离子方程式表示0.1mol/LNaHCO3溶液中存在的平衡(除水电离平衡外) 、_________。这两个平衡以__________为主。
②结合实验1、2分析,加热0.1mol/LNaHCO3溶液,pH增大的原因可能是________________(答一条)。
某研究性学习小组设计实验探究铝等金属的性质:将铝片(不除氧化膜)投入浓氯化铜溶液中,铝表面很快出现一层海绵状暗红色物质,接下来铝片上产生大量气泡。触摸容器知溶液温度迅速上升,收集气体,检验其具有可燃性。若用同样的铝片投入同浓度的硫酸铜溶液中,在短时间内铝片无明显变化。
⑴铝与氯化铜溶液能迅速反应,而与同浓度的硫酸铜溶液在短时间内不反应的原因可能是。
A.氯化铜溶液酸性比同浓度的硫酸铜溶液酸性强
B.硫酸铜水解生成硫酸使铝钝化
C.氯离子能破坏氧化铝表面薄膜,而硫酸根离子不能
D.生成氯化铝溶于水,而生成硫酸铝不溶于水
请设计一个简单实验验证你的选择:。
⑵铝片表面出现的暗红色物质的过程中发生的离子反应方程式是。用离子方程式解释产生气泡的原因:。
⑶放出的气体是,请从有关物质的浓度、能量、是否有电化学作用等分析开始阶段产生气体的速率不断加快的原因是。(写出一点即可)
⑷某同学通过一定的实验操作,也能使铝片与硫酸铜溶液反应加快,他采取的措施可能是。
A.用砂纸擦去铝片表面的氧化膜后投入硫酸铜溶液中
B.把铝片投入热氢氧化钠溶液中一段时间后,取出洗涤,再投入硫酸铜溶液中
C.向硫酸铜溶液中滴加氢氧化钠溶液,再投入铝片
D.在铝片上捆上几枚铜钉后投入同浓度的硫酸铜溶液中
⑸除去氧化铝的铝片与铜片为电极,在X电解质溶液中构成原电池,列表如下:
| 选项 |
铝电极 |
电解质 |
负极反应 |
正极反应 |
| A |
正极 |
NaOH |
Al-3e-=Al3+ |
2H2O+2e-=2OH-+H2↑ |
| B |
负极 |
稀盐酸 |
2Al-6e-=2Al3+ |
6H++6e-=3H2↑ |
| C |
正极 |
浓硝酸 |
Cu-2e--=Cu2+ |
2NO3-+4H+-4e-=2NO2↑+2H2O |
| D |
负极 |
稀硝酸 |
Cu-2e-=Cu2+ |
2NO3-+8H+=2NO↑+4H2O+6e- |
其中正确的是,由此推知,金属作电极不仅与本身性质相关,而且与 ________有关。
某化学兴趣小组测定某FeCl3样品(含少量FeCl2杂质)中铁元素的质量分数,实验室按以下步骤进行:
① 称量a g样品,置于烧杯中;
② 加入适量盐酸和适量蒸馏水,使样品溶解,然后准确配制成250mL溶液;
③ 准确量取25.0 0mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水使反应完全;
0mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水使反应完全;
④ 趁热迅速加入过量氨水,充分搅拌,使沉淀完全;
⑤ 过滤,洗涤沉淀;
⑥ 将沉淀转移到坩埚内,加热、搅拌,直到固体全部由红褐色变为红棕色后,在干燥器中冷却至室温后,称量;
⑦ 重复以上操作,至最后两次称得的质量不超过0.1g为止。
请根据上面叙述,回答:
(1)下图所示仪器中,本实验步骤①②③中必须用到的仪器是E、F和(填字母)。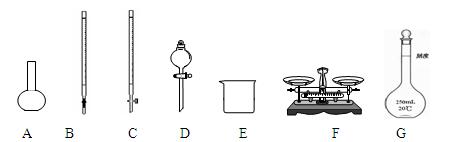
(2)步骤②加入盐酸的目的是;加快样品溶解的最简单操作是。
(3)写出步骤③中发生反应的离子方程式。
(4)步骤⑤的洗涤是洗去附着在沉淀上的(写离子符号),洗涤沉淀的操作。
(5)若坩埚质量是W1,坩埚与加热后固体总质量是W2,则样品中铁元素的质量分数为。
)某化学兴趣小组以含铁的废铝为原料制备硫酸铝晶体,设计如下的实验方案: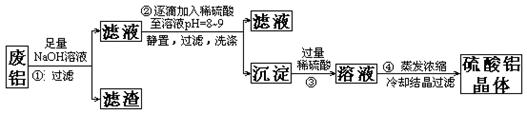
请回答以下问题:
(1)上述实验中多次用到过滤操作,该操作中要用到的玻璃仪器有;
(2)步骤②中有洗涤沉淀的操作,如何判断沉淀已洗涤干净:
;
(3)评价步骤②的操作中难以控制之处,请你提出一个合理而比较容易操作的实验方案(药品可任选)
;
(4)步骤①中使用的NaOH溶液以4mol/L为宜。某同学称量mgNaOH固体配制
V m L 4mol/L的NaOH溶液,下面是该同学配制过程的示意图,其操作中错误的是(填操作序号)。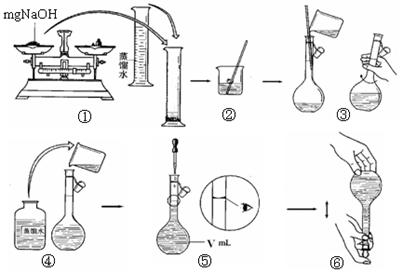
I.在足量的氯化亚铁溶液中加入少量(1—2滴)液溴,振荡后溶液变为黄色。
(1)甲同学认为是Br2单质溶于水变成黄色溶液;乙认为是Fe2+被氧化成Fe3+使溶液变成黄色。
(2)请根据提供试剂作出判断:
试剂: A 酸性高锰酸钾溶液 B 氢氧化钠溶液 C 四氯化碳 D 硫氰化钾溶液
判断: 两个同学的观点中正确的是__________(填 “甲” 或 “乙”), 并用两种方法(原理不同)加以试验证明, 写出选用的试剂编号及实验中观察到的现象:
| 选用试剂 |
实验现象 |
|
| 第一种方法 |
||
| 第二种方法 |
(3) 在FeCl3溶液中加入淀粉碘化钾溶液,能观察到的实验现象是。若选用淀粉碘化钾溶液来试验某观点的推断正确,你认为是否可行?;若可行本问不需要回答, 若不可行请说明原因: ________________________________________。
Ⅱ.若要把溶解于水中的Br2单质分离出来,所需要的主要玻璃仪器是_____, 该操作的名称是_ _
(Ⅰ)已知常温下苯酚微溶于水,溶解度为8.2g/100g水,其饱和溶液的物质的量浓度约为0.8mol/L。为了探究苯酚和乙醇分子中羟基上氢原子的活泼性,甲、乙两位同学分别设计了如下实验方案:
甲:向两只试管中,分别注入0.8mol/L的 乙醇和苯酚溶液3mL,各放入一小块金属钠,观察反应产生H2的速率。
乙醇和苯酚溶液3mL,各放入一小块金属钠,观察反应产生H2的速率。
乙:在两只试管中,分别放入1 g乙醇和苯酚晶体,各注入3mL蒸馏水,振荡,得到乙醇溶液和苯酚浊液,再向两试管中逐滴加入5mol/L的NaOH溶液,观察其中的变化。
(1)苯酚溶液与钠反应的离子方程式为_____________________________________。(2)对于甲、乙两个实验方案,他们能否达到实验目的?理由各是什么?
______________________________________________________________________。
(Ⅱ)在分析甲、乙两同学实验方案的基础上,丙同学进行了下列对比实验:
在两只试管中,分别放入2 g无水乙醇和苯酚晶体,用约60℃的水浴加热,待苯酚熔成液态后,再向两试管中各放入一小块金属钠。在乙醇中,钠块能与乙醇反应产生气体,约3min后钠块消失,溶液保持澄清;在苯酚中,钠块表面有少量气泡,约 2min后出现少量白色悬浮物,10min后白色悬浮物充满苯酚熔融液,振荡后发现钠块尚未完全消失。
2min后出现少量白色悬浮物,10min后白色悬浮物充满苯酚熔融液,振荡后发现钠块尚未完全消失。
(3)丙同学的实验表明,苯酚熔融液与钠的反应速率不如无水乙醇的快,其主要原因是____________________________________,因此苯酚熔融液和无水乙醇与钠反应的有关事实_________(填“能”或“不能”)作为判断分子里羟基上氢原子哪个更活泼的依据。 (4)请你设计一个探究苯酚和乙醇分子中羟基上氢原子活泼性的实验方案(可供选择的药品和仪器:乙醇、苯酚、蒸馏水、苯、钠、精确测
(4)请你设计一个探究苯酚和乙醇分子中羟基上氢原子活泼性的实验方案(可供选择的药品和仪器:乙醇、苯酚、蒸馏水、苯、钠、精确测 定溶液pH的仪器—pH计)
定溶液pH的仪器—pH计)