二氧化碳被认为是加剧温室效应的主要来源。2014年11月12日中美两国在北
京发表《中美气候变化联合声明》,中国政府承诺到2030年前停止增加二氧化碳排放,
为此政府大力推广二氧化碳的综合开发和利用。以CO2和NH3为原料合成尿素是固定和
利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应Ⅰ:2NH3(g)+CO2(g) NH2CO2NH4(s) △H1 =" a" kJ·mol-1
NH2CO2NH4(s) △H1 =" a" kJ·mol-1
反应Ⅱ:NH2CO2NH4(s) CO(NH2)2(s)+H2O(g) △H2 =+72.49kJ·mol-1
CO(NH2)2(s)+H2O(g) △H2 =+72.49kJ·mol-1
总反应Ⅲ:2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g) △H3 =-86.98kJ·mol-1
CO(NH2)2(s)+H2O(g) △H3 =-86.98kJ·mol-1
请回答下列问题:
(1)反应Ⅰ的△H1 =__________kJ·mol-1(用具体数据表示)。
(2)反应Ⅲ中影响CO2平衡转化率的因素很多,图1为某特定条件下,不同水碳比n(H2O)/n(CO2)和温度影响CO2平衡转化率变化的趋势曲线。
①其他条件相同时,为提高CO2的平衡转化率,生产中可以采取的措施是_________(填“提高”或“降低”)水碳比。
②当温度高于190℃后,CO2平衡转化率出现如图1所示的变化趋势,其原因是__________________。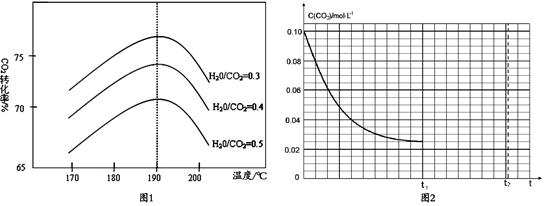
(3)反应Ⅰ的平衡常数表达式K1 =____________________。
(4)某研究小组为探究反应Ⅰ中影响c(CO2)的因素,在恒温下将0.4molNH3和0.2molCO2放入容积为2L的密闭容器中,从反应开始到达到平衡过程中c(CO2)随时间t变化趋势的曲线如图2所示。若其他条件不变,t1时将容器体积压缩到1L,请画出t1后c(CO2)随时间t变化趋势曲线(t2达到新的平衡)。
(5)尿素在土壤中会发生反应CO(NH2)2+2H2O (NH4)2CO3。下列物质中与尿素有类似性质的是______。
(NH4)2CO3。下列物质中与尿素有类似性质的是______。
| A.NH2COONH4 |
| B.H2NOCCH2CH2CONH2 |
| C.HOCH2CH2OH |
| D.HOCH2CH2NH2 |
(6)人工肾脏可用间接电化学方法除去代谢产物中的尿素,原理如图3。阳极室中发生的反应为 、 。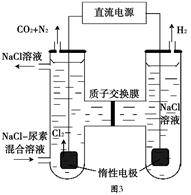
使用含氟牙膏后,会防止龋齿,这是什么道理呢?
25 ℃时,在0.5 L 0.2 mol·L-1的HA溶液中,有0.01 mol的HA电离成离子。求该温度下HA的电离常数。
已知100 kPa、298.15 K时氢氟酸的电离过程HF(aq)====H+(aq)+F-(aq) ΔH="-12.5" kJ·mol-1,ΔS="-102.5" J·mol-1·K-1,试判断该过程的自发性。
选择适宜的材料和试剂设计一个原电池,以便完成下列反应: 2FeCl3+Cu====2FeCl2+CuCl2。画出原电池的示意图并写出电极反应式。
下图为氯化钠晶体结构图,图中直线交点处为NaCl晶体中Na+与Cl-所处的位置(不考虑体积的大小)。
(1)请将其中代表Na+的圆圈用笔涂黑,以完成氯化钠晶体结构示意图并确定晶体的晶胞。
(2)从晶胞中分析氯化钠化学式为NaCl。
(3)在每个Na+周围与它最近的且距离相等的Na+有多少个?