已知铁离子,氯气、溴均为常见的氧化剂,某化学兴趣小组设计了如下实验探究其强弱: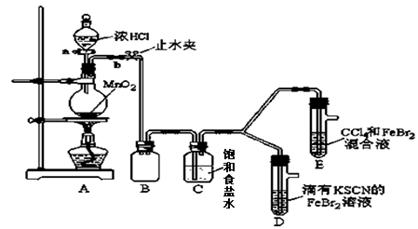
(1)①装置A中发生反应的离子方程式是 。
②整套实验装置存在一处明显的不足,请指出 。
(2)用改正后的装置进行实验,实验过程如下:
| 实验操作 |
实验现象 |
结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后 。 (填具体实验操作) |
D装置中:溶液变红 E装置中:水层溶液变黄, 振荡后,下层CCl4层无明显变化。一段时间后 。(填实验现象) |
Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: Cl2>Br2>Fe3+ |
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化。
D装置中:红色慢慢褪去。
E装置中:CCl4层颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
ⅰ.Fe3+ +3SCN- Fe(SCN)3是一个可逆反应。 Fe(SCN)3是一个可逆反应。ⅱ.(SCN)2性质与卤素单质类似。氧化性:Cl2 > (SCN)2。 |
①请用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因 。
现设计简单实验证明上述解释:取少量褪色后的溶液,滴加 溶液,若溶液颜色 。则上述解释是合理的。
小组同学另查得资料如下:
| ⅲ.Cl2和Br2反应生成BrCl,BrCl呈红色(略带黄色),沸点约5℃,它与水能发生水解反应,且该反应为非氧化还原反应。 ⅳ.AgClO、AgBrO均可溶于水。 |
②欲探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合上述资料用两步离子方程式解释仅产生白色沉淀原因 、 。
资料显示:“氨气可在纯氧中安静燃烧……某校化学小组学生设计如下装置(图中铁夹等夹持装置已略去)进行氨气与氧气在不同条件下反应的实验。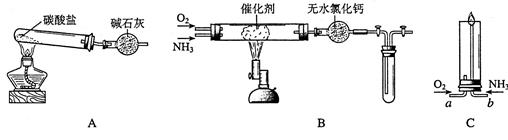
(1)用装置A制取纯净、干燥的氨气,大试管内碳酸盐的化学式是;碱石灰的作用是。
(2)将产生的氨气与过量的氧气通到装置B(催化剂为铂石棉)中,用酒精喷灯加热:
①氨催化氧化的化学方程式是试管内气体变为红棕色,该反应的化学方程式是
②停止反应后,立即关闭B中两个活塞。一段时间后,将试管浸入冰水中。试管内气体颜色变浅,请结合化学方程式说明原因
(3)将过量的氧气与A产生的氨气分别从A、B两管进气口通人到装置C中,并在B管上端点燃氨气,两气体通入的先后顺序是:先通入______(O2 ,NH3 ),后通入__________(O2,NH3)其理由是
某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验时,方方同学认为产生的气体除SO2外,还可能产生氢气。该同学为了验证他的判断是否正确,设计了如图所示的实验装置,其中,装置B中盛有浓硫酸,装置C中放置黑色CuO粉末,装置D中放置的是无水硫酸铜粉末(锌与浓硫酸共热时产生的气体为X,且该装置略去)。试回答: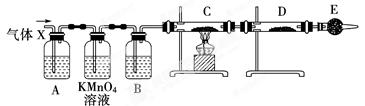
(1) E中加入的试剂是碱石灰,作用是_____________;装置A、B之间的酸性高锰酸钾溶液的作用是_________________;
(2)上述反应中生成二氧化硫的化学方程式为___________________________________;
(3)如果去掉装置B,就不能根据D中的现象判断气体X中有氢气,原因是:_______________________。
(4可以证明气体X中含有氢气的实验现象是:
C中______________________________,D中_______________________。
(14分)某学习小组同学探究FeSO4的化学性质和用途。
(一)利用下图装置探究FeSO4的稳定性和用途。(绿矾成分为FeSO4·7H2O)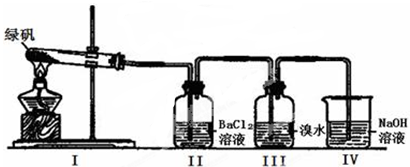
(1)II中有白色沉淀生成,说明FeSO4固体分解生成了_____________。
(2)III中溴水是用来检验是否有SO2气体生成,涉及的化学方程式为_________________,实验中,观察到溴水褪色,据此推测FeSO4分解最有可能被氧化的元素是______________。
(3)Ⅳ中足量NaOH溶液的作用是吸收SO2气体,防止其污染环境,请写出反应的离子方程式___________。
(二)探究FeSO4中Fe2+的还原性
(4)证明FeSO4有较强的还原性,完成下表步骤二及其现象。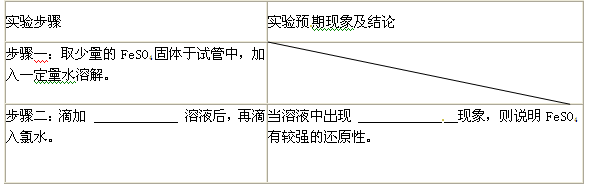
(三)硫酸亚铁用途探究
(5)缺铁性贫血往往口服硫酸亚铁,当用硫酸亚铁制成药片时,外表包有一层特殊的糖衣,其作用是_______________________。
研究性学习小组进行CH4的性质探究实验。
(1)通入高锰酸钾酸性溶液,现象是____。
(2)在无色玻璃集气瓶中与Cl2混合后光照,现象是____。
(3)为了验证CH4是否具有还原性,某小组设计了如下实验: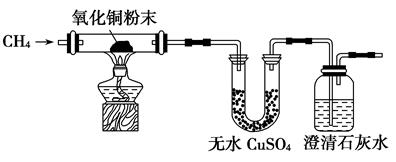
实验过程中还观察到无水CuSO4逐渐变蓝,澄清石灰水出现浑浊现象,则CH4与CuO反应的化学方程式为______。
(4)研究小组将CH4通入溴水时,发现溴水逐渐褪色,你认为原因可能是______。
请设计一个实验方案证明你的结论(用文字表示,不必画实验装置图) ______。
某学习小组为探究维生素C的组成和有关性质,进行了以下实验:
①取维生素C样品研碎,称取该试样0.704 g,置于铂舟并放人燃烧管中,不断通入氧气流。用酒精喷灯持续加热样品,样品逐渐消失最后无任何残留物,将生成物(仅有两种物质)先后通过无水硫酸铜和碱石灰,两者分别增重0.288 g和1.056 g,生成物完全被吸收。
②将少许研碎的维生素C样品和适量的紫色石蕊试液充分混合后,溶液颜色变红。
请解答下列问题:
(1)称取的试样中,含有氢原子的物质的量是mo1;碳元素的质量是g。
(2)维生素C中(填“含”、“不含”或“无法确定是否”)有氧元素,理由是根据实验数据可知。如你回答“含”有,请计算称取的试样中氧原子的物质的量并填入下一空格中;如你回答“不含”等,则下一空格不必填写。称取试样中氧原子的物质的量为mol。
(3)如果要确定维生素C的分子式,你认为还需要知道的信息是。
(4)维生素C和紫色石蕊试液混合后,溶液颜色变红,说明维生素C溶液具有(填“酸”、“碱”或“中”)性。查阅有关资料显示,维生素C具有还原性。请以淀粉溶液、碘水为试剂,写出验证维生素C具有还原性的实验方法和现象:。