【化学─选修2:化学与技术】硫酸工业的废渣回收再利用的工艺流程如下:
注:硫酸渣(主要含Fe2O3、SiO2、Al2O3、MgO等杂质)
(1)“酸浸”中硫酸要适当过量,目的是:①提高铁的浸出率,② 。
(2)“还原”是将Fe3+转化为Fe2+,同时FeS2被氧化为SO42-,该反应的离子方程式为 。
(3)为测定“酸浸”步骤后溶液中Fe3+的量以控制加入FeS2的量。实验步骤为:
准确量取一定体积的酸浸后的溶液于锥形瓶中,加入HCl、稍过量SnCl2,再加HgCl2除去过量的SnCl2,以二苯胺磺酸钠为指示剂,用K2Cr2O7标准溶液滴定,有关反应方程式如下:
2Fe3++Sn2++6Cl-=2Fe2++SnCl62-,
Sn2++4Cl-+2HgCl2=SnCl62-+Hg2Cl2↓,
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O。
①若SnCl2不足量,则测定的Fe3+量 (填“偏高”、“偏低”、“不变”,下同)。
②若不加HgCl2,则测定的Fe3+量 。
(4)①可选用 (填试剂)检验滤液中含有Fe3+。“酸浸”后Fe2+可被空气中O2氧化(用离子反应方程式表示) 。
②已知部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |
Fe(OH)3 |
Al(OH)3 |
Fe(OH)2 |
Mg(OH)2 |
Mn(OH)2 |
| 开始沉淀 |
2.7 |
3.8 |
7.5 |
9.4 |
8.3 |
| 完全沉淀 |
3.2 |
5.2 |
9.7 |
12.4 |
9.8 |
实验可选用的试剂有:稀HNO3、Ba(NO3)2溶液、酸性KMnO4溶液、NaOH溶液,要求制备过程中不产生有毒气体。请完成由“过滤”后的溶液模拟制备氧化铁的实验步骤:
第一步:氧化: ;(填写具体操作)
第二步:沉淀 ;(填写具体操作)
第三步:分离,洗涤;
第四步:烘干,研磨。
化合物A、B和C的分子式均为C7H8O2。它们分别在催化剂作用和一定反应条件下加足量的氢,均生成化合物D(C7H12O2)。D在NaOH溶液中加热反应后在酸化生成E(C6H10O2)和F(CH4O)。
A能发生如下转化: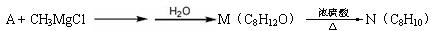
生成物N分子中只有3种不同化学环境的氢,它们的数目比为1∶1∶3。
9-1 画出化合物A、B、C、D、E、M和N的结构简式。
9-2 A、B和C互为哪种异构体?(在正确选项的标号前打钩)
①碳架异构体②位置异构体③官能团异构体④顺反异构体
9-3 A能自发转化为B和C,为什么?
9-4 B和C在室温下反应可得到一组旋光异构体L,每个旋光异构体中有个不对称碳原子。
化合物B是以β-紫罗兰酮为起始原料制备维生素A的中间体。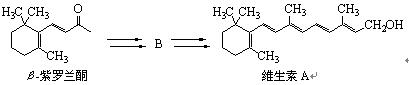
由β-紫罗兰酮生成B的过程如下所示: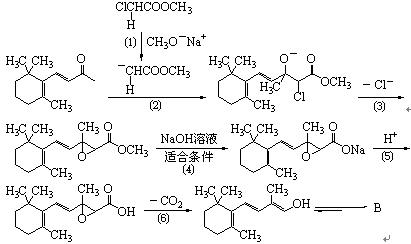
8-1 维生素A分子的不饱和度为。
8-2 芳香化合物C是β-紫罗兰酮的同分异构体,C经催化氢解生成芳香化合物D,D的1H NMR图谱中只有一个单峰。画出C的结构简式。
8-3 画出中间体B的结构简式。
8-4 以上由β-紫罗兰酮合成中间体B的过程中,⑵、⑶、⑷、⑹步反应分别属于什么反应类型(反应类型表述须具体,例如取代反应必须指明是亲电取代、亲核取代还是自由基取代)。
12000年前,地球上发生过一次大灾变,气温骤降,导致猛犸灭绝,北美Clovis文化消亡。有一种假说认为,灾变缘起一颗碳质彗星撞击地球。2010年几个研究小组发现,在北美和格林兰该地质年代的地层中存在超乎寻常浓度的纳米六方金刚石,被认为是该假设的证据。
7-1 立方金刚石的晶胞如图7-1所示。画出以两个黑色碳原子为中心的C—C键及所连接的碳原子。
7-2 图7-2上、下分别是立方金刚石和六方金刚石的碳架结构。它们的碳环构型有何不同?
7-3 六方硫化锌的晶体结构如图7-3所示。用碳原子代替硫原子和锌原子,即为六方金刚石。请在该图内用粗线框出六方金刚石的一个晶胞,要求框线必须包含图中已有的一段粗线,且框出的晶胞体积最小。
7-4 立方金刚石中周期性重复的最小单位包含个碳原子。
NO2和N2O4混合气体的针管实验是高中化学的经典素材。理论估算和实测发现,混合气体体积由V压缩为V/2,温度由298K升至311K。已知这两个温度下N2O4(g)  2NO2(g)的压力平衡常数Kp分别为0.141和0.363。
2NO2(g)的压力平衡常数Kp分别为0.141和0.363。
6-1 通过计算回答,混合气体经上述压缩后,NO2的浓度比压缩前增加了多少倍。
6-2 动力学实验证明,上述混合气体几微秒内即可达成化学平衡。压缩后的混合气体在室温下放置,颜色如何变化?为什么?
1965年合成了催化剂A,实现了温和条件下的烯烃加氢。
5-1 A是紫红色晶体,分子量925.23,抗磁性。它通过RhCl3·3H2O和过量三苯膦(PPh3)的乙醇溶液回流制得。画出A的立体结构。
5-2 A可能的催化机理如下图所示(图中16e表示中心原子周围总共有16个电子):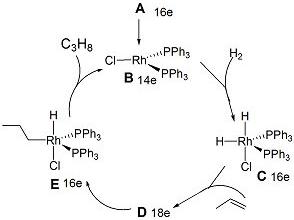
画出D的结构式。
5-3 确定图中所有配合物的中心原子的氧化态。
5-4 确定A、C、D和E的中心离子的杂化轨道类型。
5-5 用配合物的价键理论推测C和E显顺磁性还是抗磁性,说明理由。