研究氮及其化合物的性质在人类进步过程中具有极为重要的意义。
(1)已知反应:
①2H2(g)+O2(g) 2H2O(g) △H="-483.6" kJ/mol
2H2O(g) △H="-483.6" kJ/mol
②N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
③4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H=-905kJ/mol
4NO(g)+6H2O(g) △H=-905kJ/mol
则反应④4NH3(g)+3O2(g) 2N2(g)+6H2O(g)的△H=___________。
2N2(g)+6H2O(g)的△H=___________。
(2)在恒温恒容的甲容器,恒温恒压的乙容器中分别进行合成氨反应(图中所示数据均为初始物理量)。t分钟后反应均达到平衡,生成NH3均为0.4mol(忽略水对压强的影响及氨气的溶解)。
①该条件下甲容器中反应的平衡常数K= ;平衡时,甲容器的压强P = (初始压强用P0表示)。
②该条件下,若向乙中继续加入0.2 mol N2,达到平衡时N2转化率= 。
(3)在实验室中,某同学利用下列试剂及器材完成的实验能够证明NH3·H2O是弱电解质的是_________(选填字母代号)。
| A.用氨水做导电性实验,灯泡昏暗 |
| B.将氨水滴入AlCl3溶液中,产生白色沉淀 |
| C.常温下,用pH试纸测得0.1mol/L氨水的pH<13 |
| D.用湿润的蓝色石蕊试纸测得NH4Cl溶液为紫色 |
(4)常温下,向1mol•L-1NH4Cl溶液中通入少量的NH3此时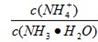 的值 (填“增大”、“减小”或“不变”);若将1mol•L-1NH4Cl溶液和1mol•L-1NaOH溶液混合后溶液恰好呈中性,则混合前NH4Cl溶液的体积 NaOH溶液的体积(填“大于”、“小于”或“等于”).
的值 (填“增大”、“减小”或“不变”);若将1mol•L-1NH4Cl溶液和1mol•L-1NaOH溶液混合后溶液恰好呈中性,则混合前NH4Cl溶液的体积 NaOH溶液的体积(填“大于”、“小于”或“等于”).
(12分)软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4·H2O ,反应的化学方程式为:MnO2+SO2=MnSO4
(1)质量为17.40g纯净MnO2最多能氧化_____L(标准状况)SO2。
(2)已知:Ksp[Al(OH)3]=1×10-33,Ksp[Fe(OH)3]=3×10-39,pH=7.1时Mn(OH)2开始沉淀。室温下,除去MnSO4溶液中的Fe3+、Al3+(使其浓度小于1×10-6mol·L-1),需调节溶液pH范围为________。
(3)下图可以看出,从MnSO4和MgSO4混合溶液中结晶MnSO4·H2O晶体,需控制结晶温度范围为_______。
(4)准确称取0.1710gMnSO4·H2O样品置于锥形瓶中,加入适量H2PO4和NH4NO3溶液,加热使Mn2+全部氧化成Mn3+,用c(Fe2+)=0.0500mol·L-1的标准溶液滴定至终点(滴定过程中Mn3+被还原为Mn2+),消耗Fe2+溶液20.00mL。计算MnSO4·H2O样品的纯度(请给出计算过程)
研究
在海洋中的转移和归宿,是当今海洋科学研究的前沿领域。
(1)溶于海水的
主要以4种无机碳形式存在,其中
占95%,写出
溶于水产生
的方程式:。
(2)在海洋循环中,通过下图所示的途径固碳。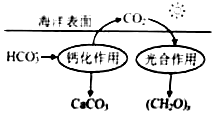
①写出钙化作用的离子方程式:。
②同位素示踪法证实光合作用释放出的
只来自于
,用
标记物质的光合作用的化学方程式如下,将其补充完整:+=
+
+
(3)海水中溶解无机碳占海水总碳的95%以上,其准确测量是研究海洋碳循环的基础,测量溶解无机碳,可采用如下方法:
①气提、吸收
,用
从酸化后的还说中吹出
并用碱液吸收(装置示意图如下),将虚线框中的装置补充完整并标出所用试剂。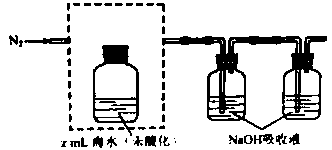
②滴定。将吸收液洗后的无机碳转化为
,再用
溶液滴定,消耗
溶液,海水中溶解无机碳的浓度=
。
(4)利用下图所示装置从海水中提取
,有利于减少环境温室气体含量。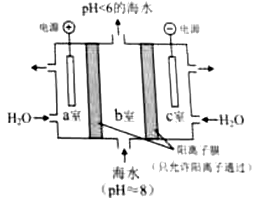
①结合方程式简述提取
的原理:。
②用该装置产生的物质处理
室排出的海水,合格后排回大海。处理至合格的方法是。
氢能是一种极具发展潜力的清洁能源。以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:
(1)反应Ⅰ的化学方程式是。
(2)反应Ⅰ得到的产物用
进行分离。该产物的溶液在过量
的存在下会分成两层--含低浓度
的
层和高浓度的
的
层。
①根据上述事实,下列说法正确的是(选填序号)。
a.两层溶液的密度存在差异
b.加
前,
溶液和HI溶液不互溶
c.
在
溶液中比在
溶液中易溶
②辨别两层溶液的方法是。
③经检测,
层中
=2.06:1。其比值大于2的原因是。
(3)反应Ⅱ:
它由两步反应组成:i.
ii.
分解。
L(L1、L2),X可分别代表压强或温度。下图表示L一定时,ii中
的平衡转化率随X的变化关系。
①X代表的物理量是。
②判断L1、L2的大小关系,并简述理由:。
硼氢化钠(
)在化工等领域具有重要的应用价值,某研究小组采用偏硼酸钠NaBO2为主要原料制备
,其流程如下:
已知:
常温下能与水反应,可溶于异丙酸(沸点:13℃)。
(1)在第①步反应加料之前,需要将反应器加热至100℃以上并通入氩气,该操作的目的是,原料中的金属钠通常保存在中,实验室取用少量金属钠需要用到的实验用品有,,玻璃片和小刀等。
(2)请配平第①步反应的化学方程式:
+□
+□
+□
==□
+□
(3)第②步分离采用的方法是;第③步分离(
)并回收溶剂,采用的方法是。
(4)
与水反应生成
和氢气,在25℃,101
下,已知每消耗3.8克
放热21.6
,该反应的热化学方程式是。
(本题共14分)钢铁是最重要、用量最大的金属材料之一。完成下列计算:
51.生产1吨含铁96%的生铁,至少需要氧化铁含量70%的赤铁矿(杂质不含铁)_____吨。(计算结果保留2位小数)
52.工业炼铁用一氧化碳还原氧化铁时会发生如下一系列反应:
3Fe2O3+CO→2Fe3O4+CO2 Fe3O4+CO→3FeO+CO2 FeO+CO→Fe+CO2
某次实验中,用CO还原4.80 g氧化铁,当固体质量变成4.56 g时,测得此固体中只存在2种氧化物。通过计算确定此固体可能的成分和它们的物质的量之比。
53.为了测定某碳素钢(假设只含铁和碳)的含碳量,将10.000 g钢样完全溶解于过量的热浓硝酸中,产生了0.300 mol气体(假设气体全部逸出,N2O4已折算为NO2)。气体用50.00 mL 12.00 mol/L的NaOH溶液完全吸收后,只生成两种盐,溶液蒸干后得到不含结晶水的固体32.664 g。计算:
(1)钢样的含碳量。
(2)参加反应的硝酸的物质的量。