X、Y、Z、M四种短周期元素的原子半径依次减小。甲、乙、丙是由它们形成的三种常见分子;甲是人体必需的基本营养物质之一,约占人体体重的2/3;乙是日常生活的基础能源,其中含元素Y的质量分数为75%;丙是具有强氧化性的弱酸。丁为丙的钠盐,常用于漂白或消毒。戊与甲的组成元素相同,其分子具有18电子。请按要求回答下列问题:
(1)元素X、Y的最高价氧化物的水化物的酸性由强到弱为(填化学式)_______;丁的电子式为___________;与甲分子具有相同电子数且含元素种类相同的离子有(填化学式)______________、______________。
(2)元素E、F与X同周期。
①常温下E的单质与甲反应缓慢,加热至沸反应迅速,滴加酚酞试液,溶液变红色;此反应的化学方程式为 。
②F的单质粉末加油漆后即得“银粉漆”,在汽车漆家族中有重要地位。写出保存“银粉”时的注意事项:________________、__________________等。
(3)向盛有一定浓度戊溶液的烧杯中逐滴加入用少量稀硫酸酸化的硫酸亚铁溶液。滴加过程中可依次观察到的现象:
a.浅绿色溶液变成黄色
b.有少量气泡产生,片刻后反应变得更剧烈,并放出较多热量
c.继续滴加溶液,静置一段时间,试管底部出现红褐色沉淀
①现象a中反应的离子方程式:________________________________________;
②现象b中反应剧烈的化学方程式:____________________________________;
③解释现象c:________________________________________________________。
(10分)某溶液中含有Ba2+、Cu2+、Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离。其流程如图(各步反应恰好完全进行)
(1)沉淀的化学式:沉淀1__________沉淀2__________沉淀3__________ ;
(2)写出混合液+A的离子方程式:_________
溶液+B的离子方程式:
(10分)现有A、B、C、D四种可溶性盐,它们的阳离子分别可能是Ba2+、Ag+、Na+、Cu2+中的某一种,阴离子则可能是NO3-, SO42-, Cl-,CO32-离子中的某一种。
(1)若把四种盐溶解在四支试管中,只有C盐溶液呈蓝色。
(2)若向(1)的四支试管中分别加入盐酸,B盐溶液中有沉淀生成,D盐溶液中有无色无味气体放出。
根据以上实验事实推断它们的化学式为:ABCD
写出B盐与盐酸反应的离子方程式
甲乙两人分别用不同的方法配制100mL 0.92 mol/L的稀硫酸。
⑴甲:量取mL98﹪密度为1.84g/cm3的浓硫酸,小心地倒入成有少量水的烧杯中,搅拌均匀再转移到100mL容量瓶中,用少量的水将烧杯玻璃棒洗涤2-3次,将每次洗涤液也转移到容量瓶中,然后小心地向容量瓶中加水 定容,塞好瓶塞,反复上下摇匀。
定容,塞好瓶塞,反复上下摇匀。
①将溶液转移到容量瓶中的正确操作是
;
②定容的正确操作是。
⑵乙:用100mL量筒量取所需体积的浓硫酸,并向其中小心地加入少量的水,均匀搅拌待冷却至室温后,再加入水至100mL刻度线,再搅拌均匀。
你认为此法是否正确?若不正确,指出其中的错误之处
。
(12分)利用如下图的装置来做下面的实验: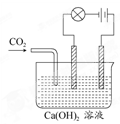
(1)先在玻璃容器里盛半杯Ca(OH)2溶液,然后由导管向容器溶液里通入CO2气体。随着CO2的通入,电灯就渐渐变暗,通入一定量时,电灯几乎完全熄灭,原因是 __________________________,如果继续通入CO2气体,电灯又会逐渐亮起来,原因是__________________________。在通入CO2的同时,能观察到溶液发生的现象是________________________,有关反应的离子方程式为_________________________。
(2)如果用氯化氢气体代替CO2气体,则观察到灯泡亮度变化是_________。有关离子反应方程式____________。
现有下列四种物质:Na2SO4、BaSO4、蔗糖(C12H22O11)、H2SO4,按照一定的依据,能找出一种物质与其它三种物质不同,从而分成两类。请你试试看,一共能找出多少种分法,把分类的依据和结果写在下面(至少填三种)
| 与其它三种不同的物质 |
分类依据 |