锡及其化合物在生产、生活中有着重要的用途。已知:Sn的熔点为231℃;Sn2+易水解、易被氧化;SnCl4极易水解、熔点为-33 ℃、沸点为114 ℃。请按要求回答下列相关问题:
(1)元素锡比同主族碳的周期数大3,锡的原子序数为_________。
(2)用于微电子器件生产的锡粉纯度测定:①取1.19 g试样溶于稀硫酸中(杂质不参与反应),使Sn完全转化为Sn2+;②加入过量的Fe2(SO4)3;③用0.1000 mol/L K2Cr2O7溶液滴定(产物中Cr呈+3价),消耗20.00 mL。步骤②中加入Fe2(SO4)3的作用是___________;此锡粉样品中锡的质量分数_____________。
(3)用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如下: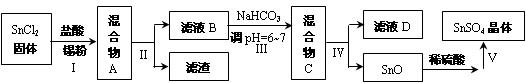
①步骤Ⅰ加入Sn粉的作用: ________________________________及调节溶液pH。
②步骤Ⅱ用到的玻璃仪器有烧杯、_______________、______________。
③步骤Ⅲ生成SnO的离子方程式:____________________________________。
④步骤Ⅳ中检验SnO是否洗涤干净的操作是______________________________,证明已洗净。
⑤步骤Ⅴ操作依次为_____________、____________、过滤、洗涤、低温干燥。
(4)SnCl4蒸气遇氨及水汽呈浓烟状,因而可制作烟幕弹,其反应的化学方程式为__________________。
实验室欲用下图装置制备少量SnCl4(夹持装置略),该装置存在明显缺陷,改进方法是__________。
利用改进后的装置进行实验,当开始装置C中收集到有SnCl4时即可熄灭B处酒精灯,反应仍可持续进行的理由是_____________________________________。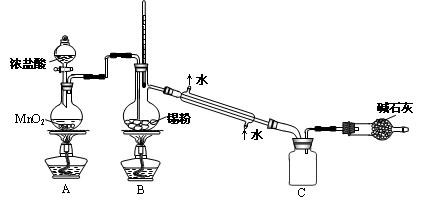
常温下,H2SO3的电离常数Ka1=1.2×10-2,Ka2=6.3×10-3,H2CO3的电离常数Ka1=4.4×10-7,Ka2=4.7×10-11。某同学设计实验验证H2SO3酸性强于H2CO3:将SO2和CO2气体分别通入水中至饱和,立即用酸度计测两溶液的pH 若前者的pH小于后者,则H2SO3酸性强于H2CO3。该实验设计不正确,错误在于。
若前者的pH小于后者,则H2SO3酸性强于H2CO3。该实验设计不正确,错误在于。
请设计合理实验验证H2SO3酸性强于H2CO3(简要说明实验步骤、现象和结论)。。仪器自选。
供选的试剂:CO2、SO2、Na2CO3、NaHCO3、Na2SO3、NaHSO3、蒸馏水、饱和石灰水、酸性KMnO4溶液、品红溶液、pH试纸。
利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组通过在实验室中模拟上述过程,其设计的模拟装置如下图所示: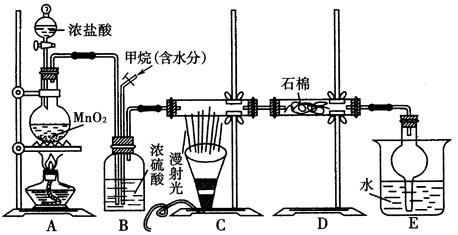
根据要求填空:
(1)B装置有三种功能:①控制气流速度;②均匀混合气体;③________________。
(2)设V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则x值应____________。
(3)E装置的作用是____________(填编号)。
| A.收集气体 | B.吸收氯气 |
| C.防止倒吸 | D.吸收氯化氢 |
(4)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式:_______________________________________。
(5)E装置除生成盐酸外,还含有有机物,从E中分离出盐酸的最佳方法为____________。该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为________(填编号)。
a.CH4 b.CH3Cl c.CH2Cl2 d.CHCl3 e.CCl4
为了验证碱金属元素和第三周期金属元素金属性的相对强弱,某课外活动小组的同学设计如下实验,请根据要求回答下列问题:
(1)取少量金属钠和金属钾分别放入盛的烧杯中,观察到钾的现象是;由此得出的结论是。
(2)将镁条打磨至银白色后放入盛有上述物质的试管中,明显现象(填“有”或“没有”),后(填操作名称)可观察到有大量气泡产生,反应的化学方程式是;
(3)将打磨好的镁条和铝条分别放入盛的试管中,观察到明显的现象,铝条反应的离子方程式是,由(1)(2)(3)可得出的结论是;
(4)某同学在学习了电化学基础知识后,设计了如图所示(X、Y分别是Mg、Al)的装置进行实验,发生氧化反应的负极金属性强,但发现镁条上有气体产生,由此得出了与实验(3)相反的结论,你知道这位同学所用的Z溶液是,其负极的电极反应式是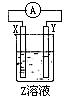
某同学为了验证Fe3+是否能氧化H2SO3生成了SO42–,他用50mL0.1mol/LFeCl3溶液吸收制取SO2气体的尾气,进行以下实验:
(1)检验吸收液中的SO42–: __________
_____________________________________________,证明Fe3+能够把H2SO3氧化成SO42–。
(2)请配平并完成上述反应中的化学方程式:
2FeCl3+SO2+==2FeCl2+H2SO4+2HCl,反应中的还原剂是 _____ (写化学式)。
(3)吸收液中除了含有H+、Cl–、SO42–以外,对其它成份(Fe3+、Fe2+、H2SO3)的可能组合进行探究:
①提出假设。
假设1:溶液中存 在Fe3+、Fe2+;
在Fe3+、Fe2+;
假设2:溶液中存在;
假设3:溶液中存在Fe2+ 而不存在H2SO3(二者恰好完全反应)。
②设计方案、进行实验,验证假设。请在表中写出实验步骤以及预期现象和结论(可以不填满)。限选实验试剂和仪器:试管、滴管、0.1moL L-1KMnO4、0.1moL
L-1KMnO4、0.1moL L-1KSCN溶液、品红
L-1KSCN溶液、品红 稀溶液。
稀溶液。
| 实验步骤 |
预期现象和结论 |
| 步骤1:用试管取样品溶液2-3mL,再用滴管取 |
若出现血红色,则假设1成立;若未出现血红色,则假设2或假设3成立。 |
| 步骤2: |
结合步骤1的现象和结论, ________________________________________. |
某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯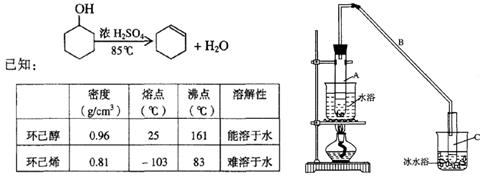
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入lmL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是,导管B除了导气外还具有的作用是。
②试管C置于冰水浴中的目的是。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在层(填上或下),分液后用_________(填入编号,单选)洗涤。
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3 溶液
溶液
②再将环己烯按下图装置蒸馏,冷却水从_________口进入,目的是_____________________________。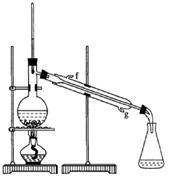
③收集产品时,控制的温度应在_________左右 ,实验制得的环己烯精品质量低于理论产量,可能的原因是(单选)
,实验制得的环己烯精品质量低于理论产量,可能的原因是(单选)
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出