室温下,下列溶液中粒子浓度大小关系正确的是
| A.0.1mol/LNaHCO3溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) |
| B.pH相同的①CH3COONa②NaHCO3③NaAlO2三份溶液中的c(Na+):②>③>① |
| C.0.1mol•L-1的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S) |
| D.上图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH) |
X、Y、Z、M代表四种金属元素.金属X和Z用导线连接放入稀硫酸中时,X溶解,Z极上有氢气放出;若电解Y2+和Z2+离子共存的溶液时,Y先析出;又知M2+离子的氧化性强于Y2+离子.则这四种金属的活动性由强到弱的顺序为
| A.X>Y>Z>M | B.X>Z>Y>M |
| C.M>Z>X>Y | D.X>Z>M>Y |
己知N2(g)+3H2(g)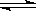 2NH3(g)△H=﹣92.4kJ•mo1﹣1,下列结论正确的是
2NH3(g)△H=﹣92.4kJ•mo1﹣1,下列结论正确的是
| A.在密闭容器中加入1mol N2和3mol H2充分反应放热92.4kJ |
B.N2(g)+3H2(g)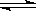 2NH3(l)△H=﹣QkJ•mo1﹣1,则Q>92.4 2NH3(l)△H=﹣QkJ•mo1﹣1,则Q>92.4 |
| C.增大压强,平衡向右移动,平衡常数增大 |
| D.若一定条件下反应达到平衡,N2的转化率为20%,则H2的转化率为60% |
已知温度T时水的离子积常数为KW,该温度下,将浓度为a mol•L﹣1的一元酸HA与b mol•L﹣1一元碱BOH等体积混合,可判定该溶液呈中性的依据是
| A.a=b |
| B.混合溶液的pH=7 |
C.混合溶液中,c(H+)= mol•L﹣1 mol•L﹣1 |
| D.混合溶液中,c(H+)+c(B﹣)=c(OH﹣)+c(A﹣) |
在1200℃时,天然气脱硫工艺中会发生下列反应:
H2S(g)+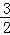 O2(g)═SO2(g)+H2O(g)△H1
O2(g)═SO2(g)+H2O(g)△H1
2H2S(g)+SO2(g)═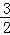 S2(g)+2H2O(g)△H2
S2(g)+2H2O(g)△H2
H2S(g)+ O2(g)═S(g)+H2O(g)△H3
O2(g)═S(g)+H2O(g)△H3
2S(g)═S2(g)△H4
则△H4的正确表达式为
A.△H4=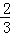 (△H1+△H2﹣3△H3) (△H1+△H2﹣3△H3) |
B.△H4=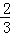 (3△H3﹣△H1﹣△H2) (3△H3﹣△H1﹣△H2) |
C.△H4=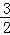 (△H1+△H2﹣3△H3) (△H1+△H2﹣3△H3) |
D.△H4=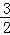 (△H1﹣△H2﹣3△H3) (△H1﹣△H2﹣3△H3) |
欲迅速除去铁壶底的水垢,最好的办法是用
| A.浓盐酸 | B.稀硝酸 | C.浓硫酸 | D.浓硝酸 |