向100 mL稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉,产生气体的体积(相同状况)随铁粉质量增加的变化如图所示。下列分析错误的是.
A.原混合酸溶液的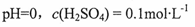 |
B.OA段的反应为: |
C.AB段的反应为: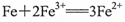 |
| D.BC段气体产物为氢气 |
下列食品添加剂与类别对应正确的一组是
| A.着色剂——胡萝卜素、苯甲酸钠 |
| B.调味剂——亚硝酸钠、味精 |
| C.防腐剂——日落黄、山梨酸钾 |
| D.营养强化剂——酱油中加铁、粮食制品中加赖氨酸 |
关于食物的酸碱性,下列说法正确的是
A.食物溶于水后的 溶液中pH < 7,则为酸性食物
溶液中pH < 7,则为酸性食物
B.由C、N、S、P等元素组成的蛋白质是酸性食物
C.蔬菜、水果多含钾、钠、钙、镁等盐类及果酸,习惯称为酸性食物
D.柠檬酸是酸性食物
下列关于水的说法正确的是
| A.我们平时应多饮用很纯净的水,防止有毒物质进入体内 |
| B.所有天然水都不能饮用 |
| C.人体内含有约2/3体重的水,故人每天不用喝水也可 |
| D.人类可利用的水只占自然界的水中极少量,我们应节约用水 |
关于维生素的下列说法不正确的是
| A.维生素是生物生长发育和新陈代谢所必需的物质 |
| B.按溶解性的不同,维生素可分为脂溶性维生素和水溶性维生素两类 |
| C.水溶性维生素不易被人体吸收,所以容易缺乏 |
| D.脂溶性维生素不易排泄,容易在体内积存,主要积存在肝脏 |
蛋白质是人体必需的重要营养成分之一。下列食物中,富含蛋白质的是
| A.豆腐 | B.甘蔗 | C.白菜 | D.猪油 |