乙醛酸(HOOC-CHO)是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图所示。该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸。下列说法不正确的是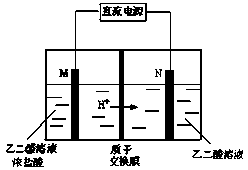
| A.N电极上的电极反应式:HOOC-COOH+2e-+2H+=HOOC-CHO+H2O |
| B.若有2 mol H+ 通过质子交换膜并完全参与反应,则该装置中生成的乙醛酸为1 mol |
| C.M电极上的电极反应式为:2Cl--2e-=Cl2↑ |
| D.乙二醛与M电极的产物反应生成乙醛酸的化学方程式: Cl2+OHC-CHO+ H2O = HOOC-CHO+2HCl |
下列说法正确的是()
| A.同一主族元素气态氢化物从上到下,其沸点逐渐升高 |
| B.非金属单质中一定存在共价键,离子化合物中可能存在共价键 |
| C.非极性键不可能存在于离子化合物中,由非金属元素组成的化合物中一定不存在离子键 |
| D.含有阴离子的物质一定含有阳离子 |
已知X+、Y2+、Z﹣、W2﹣四种离子具有相同的电子层结构.下列关于X、Y、Z、W四种元素的描述,不正确的是()
| A.金属性:X>Y,还原性:Z﹣>W2﹣ | B.原子半径:X>Y>W>Z |
| C.离子半径:Y2+<X+<Z﹣<W2﹣ | D.原子序数:Y>X>Z>W |
三氟化氮(NF3)是微电子工业中一种优良的等离子蚀刻气体.它无色、无臭,在潮湿的空气中能发生下列反应:3NF3+5H2O=2NO+HNO3+9HF,下列有关说法正确的是()
| A.反应中NF3是氧化剂,H2O是还原剂 |
| B.NF3在潮湿空气中泄漏会产生白雾、红棕色气体等现象 |
| C.若反应中生成0.2molHNO3,则反应共转移0.2mole﹣ |
| D.反应中被氧化与被还原的原子物质的量之比为2:1 |
下列叙述的两个量,一定相等的是()
| A.质量相等的金刚石和C60中的碳原子数目 |
| B.0.1 mol/L NaCl溶液与0.05 mol/L Na2CO3溶液中所含Na+的数目 |
| C.标准状况下等体积的SO2和SO3的分子数目 |
| D.同温同压相同体积的两种气体12C18O和14N2的密度 |
若NA代表阿伏加德罗常数,下列说法正确的是()
| A.1 molCl2参加反应转移电子数一定为2 NA |
| B.将31g的Na2O溶解于1L水中,所得溶液中Na+的物质的量浓度为1 mol/L |
| C.22.4L的NH3和16g CH4中所含有的电子数都是10NA |
| D.20g重水(2H216O)含有的电子数为10NA |