a-5X、b-3Y、aZ、bW、a+4T均为短周期元素,其原子半径随原子序数变化如下图所示。Z是地壳中含量最高的金属元素,W原子最外层电子数是K层电子数的2倍。则下列说法正确的是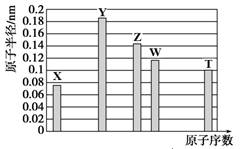
| A.Z、T两种元素的离子半径相比,前者较大 |
| B.X、Y形成的两种化合物中,阴、阳离子物质的量之比分别为1∶1和1∶2 |
| C.X、W、T三种元素的气态氢化物中,稳定性最差的是W的氢化物,沸点最高的是T的氢化物 |
| D.Y、T两种元素的最高价氧化物对应的水化物均能溶解X和Z形成的常见化合物 |
化工生产中含Cu2+的废水常用MnS(s)作沉淀剂,其反应原理为Cu2+(aq)+MnS(s) CuS(s)+Mn2+(aq)。下列有关该反应的推理不正确的是()
CuS(s)+Mn2+(aq)。下列有关该反应的推理不正确的是()
| A.该反应达到平衡时:c(Cu2+)=c(Mn2+) |
| B.CuS的溶解度比MnS的溶解度小 |
| C.往平衡体系中加入少量Cu(NO3)2(s)后,c(Mn2+)变大 |
| D.该反应平衡常数表达式:K=Ksp(MnS)/Ksp(CuS) |
液态化合物AB会发生微弱的自身电离,电离方程式为AB A++B-,在不同温度下其平衡常数为K(25 ℃)=1.0×10-14,K(35 ℃)=2.1×10-14。则下列叙述正确的是()
A++B-,在不同温度下其平衡常数为K(25 ℃)=1.0×10-14,K(35 ℃)=2.1×10-14。则下列叙述正确的是()
| A.c(A+)随温度升高而降低 |
| B.在35 ℃时,c(A+)>c(B-) |
| C.AB的电离程度(25 ℃)>(35 ℃) |
| D.AB的电离是吸热过程 |
在某一体积可变的恒温密闭容器中发生如下反应:A(g)+B(g) 2C(g) ΔH<0。t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图所示。下列说法正确的是()
2C(g) ΔH<0。t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图所示。下列说法正确的是()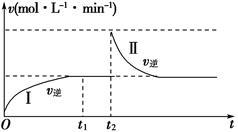
| A.0~t2时,v正>v逆 |
| B.Ⅰ、Ⅱ两过程达到平衡时,A的体积分数Ⅰ>Ⅱ |
| C.t2时刻改变的条件可以是向密闭容器中加C |
| D.Ⅰ、Ⅱ两过程达到平衡时,平衡常数Ⅰ<Ⅱ |
在密闭容器中充入一定量的NO2,发生反应2NO2(g) N2O4(g) ΔH=-57 kJ·mol-1。在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是()
N2O4(g) ΔH=-57 kJ·mol-1。在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是()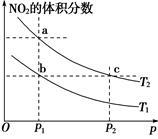
| A.a、c两点的反应速率:a>c |
| B.a、b两点NO2的转化率:a<b |
| C.a、c两点气体的颜色:a深,c浅 |
| D.由a点到b点,可以用加热的方法 |
处于平衡状态的反应2H2S(g) 2H2(g)+S2(g) ΔH>0,不改变其他条件的情况下合理的说法是()
2H2(g)+S2(g) ΔH>0,不改变其他条件的情况下合理的说法是()
| A.加入催化剂,反应路径将发生改变,ΔH也将随之改变 |
| B.升高温度,正逆反应速率都增大,H2S分解率也增大 |
| C.增大压强,平衡向逆反应方向移动,将引起体系温度降低 |
| D.若体系恒容,注入一些H2后达新平衡,H2浓度将减小 |