(15分)高铁酸钾(K2FeO4)是一种绿色氧化剂,在许多领域展现出广阔的应用前景。
(1)湿法制备K2FeO4:在KOH溶液中,用KC10直接氧化Fe(NO3)3即可制得K2FeO4。该反应的离子方程式为_________________________________。
(2)测定K2FeO4:样品纯度:i.称取样品mg,加入到盛有过量碱性亚铬酸钠[NaCr(OH)4]溶液的锥形瓶中充分反应;ii.将所得铬酸钠(Na2CrO4)溶液酸化;iii.在所得Na2Cr2O7溶液中加入8—9滴二苯胺磺酸钠溶液作指示剂,用c mol·L-1(NH4)2Fe(SO4)2溶液滴定至终点,消耗溶液体积为V mL。整个过程中发生的反应如下:
i. Cr(OH)4- + FeO42-+  = Fe(OH)3 (H2O)3↓+ CrO42-+
= Fe(OH)3 (H2O)3↓+ CrO42-+
ii.2CrO42-+2H+=Cr2O72-+H2O;
iii.Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
①配平方程式i;
②利用上述数据计算该样品的纯度为________________(用含字母的代数式表示)。
(3)高铁酸盐在水溶液中有四种含铁形体。25 ℃时,它们的物质的量分数随pH的变化如图所示: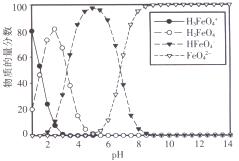
i.pH=2.2时,溶液中主要含铁形体浓度的大小关系为________;为获得尽可能纯净的高铁酸盐,pH应控制在______________。
ii.已知H3FeO4+ 的电离常数分别为:K1=2.51×10-2,K2=4.16×10-4,K3=5.01×10-8,当pH=4时,溶液中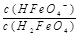 = 。
= 。
iii.向pH=6的高铁酸盐溶液中加入KOH溶液,发生反应的离子方程式为______________。
(4)某新型电池以金属锂为负极,K2FeO4为正极,溶有LiPF6的有机溶剂为电解质。工作时Li+通过电解质迁移人K2FeO4晶体中,生成K2Li2FeO4。该电池的正极反应式为______________.
自然界中的溶洞景观,千奇百怪,引人入胜。在惊叹自然界美丽之余,你是否想过,如此坚硬的石头怎么会溶成一个大洞呢?请解释之。
使用含氟牙膏后,会防止龋齿,这是什么道理呢?
25 ℃时,在0.5 L 0.2 mol·L-1的HA溶液中,有0.01 mol的HA电离成离子。求该温度下HA的电离常数。
已知100 kPa、298.15 K时氢氟酸的电离过程HF(aq)====H+(aq)+F-(aq) ΔH="-12.5" kJ·mol-1,ΔS="-102.5" J·mol-1·K-1,试判断该过程的自发性。
选择适宜的材料和试剂设计一个原电池,以便完成下列反应: 2FeCl3+Cu====2FeCl2+CuCl2。画出原电池的示意图并写出电极反应式。