还原沉淀法是处理含铬(含Cr2O72-和CrO42-)工业废水的常用方法,过程如下:
已知转化过程中的反应为 。
。
转化后所得溶液中铬元素的含量为28.6 g/L,CrO42-有10/11转化为Cr2O72-,下列说法不正确的是
| A.溶液颜色保持不变,说明上述可逆反应达到平衡状态 |
B.若用绿矾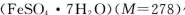 作还原剂,处理1L废水,至少需要917.4 g 作还原剂,处理1L废水,至少需要917.4 g |
| C.常温下转化反应的平衡常数K=l×10.则转化后所得溶液的pH=6 |
D.常温下 ,要使处理后废水中的c(Cr3+)降至1×10 ,要使处理后废水中的c(Cr3+)降至1×10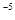 mol/L,应调溶液的pH=5 mol/L,应调溶液的pH=5 |
氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)水是人体的重要组成成分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原反应的关系”也可用如下图表达。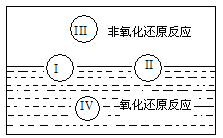
试写出有水参加的符合反应类型Ⅳ的一个化学方程式:___________________,其中水为________剂
(2)氯化铵常用作焊接。如:在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为:
CuO+____NH4Cl ____Cu+____CuCl2+N2↑+____H2O。
____Cu+____CuCl2+N2↑+____H2O。
①配平此氧化还原反应方程式。
②该反应中,被氧化的元素是________(填元素名称),氧化剂是________(填化学式)。
(3)磷酸钙与焦炭、石英砂混合,在电炉中加热到1 500 ℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2===6CaSiO3+P4O10, 10C+P4O10===P4+10CO。
每生成1 mol P4时,就有________mol电子发生转移。
已知:将Cl2通入适量KOH溶液,产物中可能有KCl、KClO、KClO3,且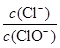 的值与温度高低有关。当n(KOH)=a mol时,下列有关说法错误的是( )
的值与温度高低有关。当n(KOH)=a mol时,下列有关说法错误的是( )
A.若某温度下,反应后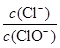 =11,则溶液中 =11,则溶液中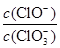 = = |
B.参加反应的氯气的物质的量等于 a mol a mol |
C.改变温度,产物中KClO3的最大理论产量为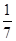 mol mol |
D.改变温度,反应中转移电子的物质的量ne的范围: a mol≤ne≤ a mol≤ne≤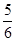 a mol a mol |
下列实验方案中,不能达到实验目的的是( )
| 选项 |
实验目的 |
实验方案 |
| A |
检验CH3CH2Br在NaOH溶液中是否发生水解 |
将CH3CH2Br与NaOH溶液共热。冷却后,取出上层水溶液,用稀HNO3酸化,加入AgNO3溶液,观察是否产生淡黄色沉淀 |
| B |
检验Fe(NO3)2晶体是否已氧化变质 |
将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红 |
| C |
验证Br2的氧化性强于I2 |
将少量溴水加入KI溶液中,再加入CCl4,振荡,静置,可观察到下层液体呈紫色 |
| D |
验证Fe(OH)3的溶解度小于Mg(OH)2 |
将FeCl3溶液加入Mg(OH)2悬浊液中,振荡,可观察到沉淀由白色变为红褐色 |
分子式为C10H14的单取代芳烃,其可能的结构有( )
| A.2种 | B.3种 | C.4种 | D.5种 |
下列说法正确的是( )
| A.油脂在酸性或碱性条件下均可发生水解反应,且产物相同 |
| B.用核磁共振氢谱不能区分HCOOCH3和HCOOCH2CH3 |
| C.用Na2CO3溶液不能区分CH3COOH和CH3COOCH2CH3 |
| D.室温下,在水中的溶解度:丙三醇>苯酚>1氯丁烷 |