铜、铝、硫及其它们的化合物应用广泛,如Cu可用作催化剂、制作印刷电路铜板等。
Ⅰ.铜的冶炼:工业上以辉铜矿为原料,采用火法熔炼工艺生产铜。
火法炼铜的方程式为: ,该工艺的中间过程会发生反应2Cu20+辉铜矿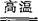 6Cu+ m↑,若反应每生成5.6 L(标准状况下)m气体.则转移电子的物质的量为 。
6Cu+ m↑,若反应每生成5.6 L(标准状况下)m气体.则转移电子的物质的量为 。
Ⅱ.粗铜精炼:利用电解法可将含有Fe、Zn、Ag、Pt等杂质的粗铜提纯,下列叙述正确的是 。
| A.电解时以精铜作阳极 |
| B.电解时阴极发生氧化反应 |
| C.粗铜连接电源负极,其电极反应是Cu一2e—=Cu2+ |
| D.电解后.电解槽底部会形成含少量Ag、Pt等金属的阳极泥 |
E.整个过程溶液中的Cu2+浓度减少
Ⅲ.铜及其化合物的性质探究:
将洁净的铜丝放在火焰上加热.并趁热插入到乙醇中,铜丝表面的现象为 ,
发生的反应为 。
Ⅳ.无水氯化铝是一种重要的化工原料。利用明矾石:K2SO4·A12(SO4)3·2A1203·6H20]制备无水氯化铝的流程如下: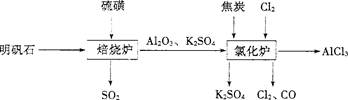
(1)验证焙烧炉产生的气体含有SO2的方法是 。
(2)吸收焙烧炉中产生的S02,下列装置合理的是 (填代号)。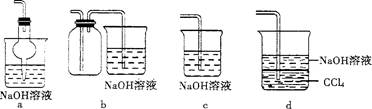
(3)氯化炉中发生反应的化学反应方程式为 。
(4)生产氯化铝的过程中会产生SO2、Cl2等大气污染物,若将二者按照一定比例通入水中可减少或消除污染。试设计简单实验检验二者是否恰好完全反应。(简要捕述实验步骤、现象和结论) 。
仪器自选;可供选择试剂如下:①滴加酚酞的氢氧化钠溶液 ②氯化亚铁溶液 ③硫氰化钾溶液 ④品红溶液
(5)某实验小组设计了电化学方法进行二氧化硫的回收利用。利用电化学法将尾气中的SO2气体转化为 氮肥硫酸铵,模拟装置如图: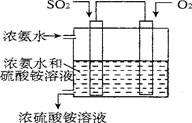
试写出SO2气体发生的电极反应式为 。
向300mL 1.0mol/L的NaOH溶液中通入标准状况下4.48LCO2气体,充分反应后,所得溶液中:
(1)离子浓度大小关系:
(2)电荷守恒:
(3)物料守恒:
(4)质子守恒:
怎样用化学方法除去下列物质中混有的少量杂质,写出除杂需加入的试剂以及发生反应的离子方程式。
| 需加入的除杂试剂 |
发生反应的离子方程式 |
|
| ①CO2气体中混有HCl杂质 |
|
|
| ②NaHCO3溶液中混有Na2CO3 |
|
|
| ③FeCl2溶液中混有FeCl3杂质 |
|
|
| ④Fe2O3固体中混有Al2O3杂质 |
|
学法题:归纳总结除杂试剂选择的方法
有A、B、C三种烃,分子式都是C5H10,经在一定条件下与足量H2反应,结果得到相同的生成物,写出这三种烃可能的结构简式并命名。
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定。
(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)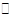 2NH3(g)+CO2(g)
2NH3(g)+CO2(g)
实验测得不同温度下的平衡数据列于下表:
| 温度/℃ |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
| 平衡总压强/kPa |
5.7 |
8.3 |
12.0 |
17.1 |
24.0 |
| 平衡气体总浓 度/mol·L-1 |
2.4×10-3 |
3.4×10-3 |
4.8×10-3 |
6.8×10-3 |
9.4×10-3 |
①可以判断该分解反应已经达到平衡的是_______________ 。
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0 ℃时的分解平衡常数:________。
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0 ℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量_________________ (填“增加”,“减少”或“不变”)。
④氨基甲酸铵分解反应的焓变ΔH_______________0(填“>”、“=”或“<”),熵变ΔS________________0(填“>”、“=”或“<”)。
(2)已知:NH2COONH4+2H2O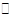 NH4HCO3+NH3·H2O
NH4HCO3+NH3·H2O
该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间的变化趋势如下图所示。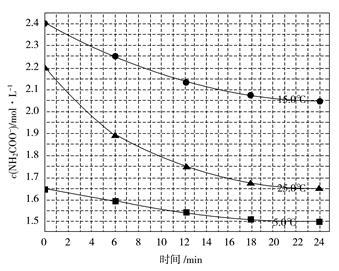
⑤计算25.0 ℃时,0~6 min氨基甲酸铵水解反应的平均速率:________。
⑥根据图中信息,如何说明该水解反应速率随温度升高而增大:______________ _______________________________。
在80℃时,0.40mol的N2O4气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) n(mol) |
0 |
20 |
40 |
60 |
80 |
100 |
| n(N2O4) |
0.40 |
a |
0.20 |
c |
d |
e |
| n(NO2) |
0.00 |
0.24 |
b |
0.52 |
0.60 |
0.60 |
已知:N2O4 2NO2,△H>0,
2NO2,△H>0,
(1)计算20s~40s内用N2O4表示的平均反应速率为 。
(2)计算在80℃时该反应的平衡常数K= 。
(3)反应进行至100s后将反应混合物的温度降低,混合气体的颜色 (填“变浅”、“变深”或“不变”)。
(4)要增大该反应的K值,可采取的措施有(填序号) ,若要重新达到平衡时,使c(NO2)/c(N2O4)值变小,可采取的措施有(填序号) 。
A、增大N2O4的起始浓度 B、向混合气体中通入NO2
C、使用高效催化剂D、升高温度
(5)如图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60℃时N2O4物质的量的变化曲线。