在80℃时,0.40mol的N2O4气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) n(mol) |
0 |
20 |
40 |
60 |
80 |
100 |
| n(N2O4) |
0.40 |
a |
0.20 |
c |
d |
e |
| n(NO2) |
0.00 |
0.24 |
b |
0.52 |
0.60 |
0.60 |
已知:N2O4 2NO2,△H>0,
2NO2,△H>0,
(1)计算20s~40s内用N2O4表示的平均反应速率为 。
(2)计算在80℃时该反应的平衡常数K= 。
(3)反应进行至100s后将反应混合物的温度降低,混合气体的颜色 (填“变浅”、“变深”或“不变”)。
(4)要增大该反应的K值,可采取的措施有(填序号) ,若要重新达到平衡时,使c(NO2)/c(N2O4)值变小,可采取的措施有(填序号) 。
A、增大N2O4的起始浓度 B、向混合气体中通入NO2
C、使用高效催化剂 D、升高温度
(5)如图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60℃时N2O4物质的量的变化曲线。

A、B、C、D四种元素,已知A元素是自然界中含量最多的元素;B元素为金属元素,它的原子核外K、L层上电子数之和等于M、N层电子数之和;C元素是第3周期第一电离能最小的元素;D元素在第3周期中电负性最大。
(1)试推断A、B、C、D四种元素的名称和符号。
(2)写出上述元素两两化合生成的离子化合物的化学式。
已知某元素在周期表中位于第5周期ⅥA位置上,试写出该元素的基态原子的结构式、元素的名称、符号和原子序数。
画出V,Si,Fe电子轨道图,并指出这些原子各有几个未成对电子?
短周期元素A、B、C、D中,0.5 mol A元素的离子得到6.02×1023个电子被还原为中性原子,0.4 g A的氧化物恰好与100 mL 0.2 mol·L-1的盐酸完全反应。A元素原子核内质子数与中子数相等,B元素原子核外M能层电子数比K能层多1,C-的核外电子排布为[Ne]3s23p6,D元素原子核外L能层比K能层多2个电子,请完成:
(1)写出A、B、C、D四种元素的名称。
(2)画出C-和D原子的结构示意图。
(3)向B、C两元素形成的化合物的水溶液中逐滴滴入苛性钠溶液,有什么现象发生?写出有关反应的离子方程式。
下列原子的外围电子排布式(或外围轨道表示式)中,哪一种状态的能量较低?试说明理由。
(1)氮原子:A.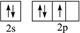 B.
B.
(2)钠原子:A.3s1 B.3p1
(3)铬原子:A.3d54s1 B.3d44s2
(4)碳原子: