(8分)KMnO4溶液常用作氧化还原反应滴定的标准液,由于KMnO4的强氧化性,它的溶液很容易被空气中或水中某些少量还原性物质还原,生成难溶性物质MnO(OH)2,因此配制KMnO4标准溶液的操作是:(1)称取稍多于所需量的KMnO4固体溶于水,将溶液加热并保持微沸1h;(2)用微孔玻璃漏斗过滤除去难溶的MnO(OH)2;(3)过滤得到的KMnO4溶液贮存于棕色试剂瓶放在暗处;(4)利用氧化还原滴定方法,在700C-800C条件下用基准试剂(纯度高、式量较大、稳定性较好的物质)溶液标定其浓度。请回答下列问题:
(1)将溶液加热并保持微沸1h的目的是 。
(2)如何保证在700C~800C条件下进行滴定操作: 。
(3)准确量取一定体积的KMnO4溶液用________________(填仪器名称)。
(4)在下列物质中,用于标定KMnO4溶液的基准试剂最好选用_________(填序号)。
| A.H2C2O4·2H2O | B.FeSO4 | C.浓盐酸 | D.Na2SO3 |
(5)若准确称取Wg你选的基准试剂溶于水配成500 mL水溶液,取25.00 mL置于锥形瓶中,用高锰酸钾溶液滴定至终点,消耗高锰酸钾溶液VmL。问:
①滴定终点标志是__________ __________;
②所配制KMnO4标准溶液的物质的量浓度为_______________mol/ L;
(6)若用放置两周的KMnO4标准溶液去滴定水样中Fe2+含量,测得的浓度值将____(填“偏高”或“偏低”)。
已知化合物A可以发生如图所示的反应。回答下列问题: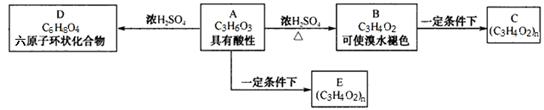
已知:A可以和碳酸钠反应生成二氧化碳,且1molA和足量钠反应生成1mol氢气。
(1)A的结构简式为___________;D的结构简式为___________。
(2)下列有关物质C和物质E关系叙述正确的是_________(填编号)
a.同种物质 b.同分异构体 c.不同的单体 d.不同的化学性质
(3) A→B的化学反应方程式为__________________________。
(4)F是A的同分异构体,已知F分子结构中不含有甲基,且可以使氢氧化钠的酚酞溶液缓慢褪色,则F的结构简式为__________。
某校化学探究小组探究有机化合物A的结构简式,其基本过程如下:
(1)取4.2g该有机化合物燃烧,将燃烧产物依次通入浓硫酸、足量澄清石灰水溶液,实验后,浓硫酸增重1.8g,生成碳酸钙的质量为20g,由此可确定A的最简式为_________。
(2)由质谱分析测定出A的相对分子质量为84,由此可确定A的分子式为_________。
(3)取8.4gA和足量银氨溶液反应,最终生成43.2g银,由此可确定A的结构简式为_____。
锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,氢氧化锌溶于氨水生成Zn(NH3)22+。回答下列问题:
(1)单质铝溶于氢氧化钠溶液后,溶液中铝元素的存在形式为(用化学式表达)。 (2)写出锌和氢氧化钠溶液反应的化学方程式。
(3)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是。
①硫酸铝和氢氧化钠 ②硫酸铝和氨水 ③硫酸锌和氢氧化钠 ④硫酸锌和氨水
(4)写出可溶性铝盐与氨水反应的离子方程式____________________________________________。试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因___________________________。
(1)有一瓶存放时间较长的硫酸亚铁,外观上并无明显变化,但某学生怀疑其有部分因氧化而变质,请你设计1个检验硫酸亚铁是否变质的实验方案:。如果有变质,当配制硫酸亚铁溶液时,应如何除去变质的杂质?。
(2)FeCl3溶液棕黄色,对此溶液,分别做如下实验,请填表:
| 编号 |
实践操作 |
实验主要现象 |
离子方程式 |
| ① |
加入过量铁粉 |
||
| ② |
加入少量Na2O2粉末 |
||
| ③ |
加入少量AgNO3溶液 |
在实验室里,某同学取一小块金属钠做钠与水反应的实验。试完成下列问题:
(1)切开的金属钠暴露在空气中,最先观察到的现象是____________________________,所发生反应的化学方程式是_______________________________________________。
(2)将钠投入水中后,钠熔化成一个小球,根据这一现象你能得出的结论是
①_______________________________________________,
②_______________________________________________。
将一小块钠投入盛有饱和石灰水的烧杯中,不可能观察到的现象是________。
| A.有气体生成 |
| B.钠熔化成小球并在液面上游动 |
| C.烧杯底部有银白色的金属钙生成 |
| D.溶液变浑浊 |
(3)钠与硫酸铜溶液反应的离子方程式为____________________________________。在反应过程中,若生成标准状况下224 mL的H2,则转移的电子的物质的量为________。