现有部分短周期元素的性质或原子结构如下表:
| 元素编号 |
元素性质或原子结构 |
| T |
M层的电子数为K层电子数的3倍 |
| X |
其氢化物的空间构型为正四面体 |
| Y |
常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z |
元素最高正价是+7价 |
(1)元素T的阴离子的结构示意图 ;元素X的最高价氧化物的电子式 ;
(2)元素Y 在周期表中位于 周期, 族。该元素的最高价氧化物对应水化物与其氢化物能生成盐M,M中含有的化学键类型有 ;
(3)四种元素最高价氧化物对应的水化物中酸性最强的是 (填物质化学式)
(4)元素Z与元素T相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是
a. 常温下Z的单质和T的单质状态不同
b. Z的氢化物比T的氢化物稳定
c. Z的最高价氧化物所对应的水化物比T的最高价氧化物所对应的水化物的酸性强
d. Z的氢化物比T的氢化物溶解度大
e. Z的单质与H2化合比 T的单质与H2化合更容易
(5)含有34个电子的元素X的氢化物的分子式
(6)写出实验室制备Z单质的化学方程式:
(7)比较T和Z的简单离子的半径大小: (用元素离子符号表示)
A、B、C三种元素的原子具有相同的电子层数,而B的核电荷数比A大2,C原子的电子总数比B原子电子总数多4。1molA单质跟盐酸反应可置换出11.2L(标准状况下)氢气,这时A转变成与氖原子具有相同电子层结构的离子。试回答:
(1)A_________ B _________ C _________(填化学符号)
(2)分别写出A、B最高价氧化物对应水化物分别跟C的气态氢化物水溶液反应的离子方程式:________________________ ___________________________
(3)A离子的氧化性比B离子的氧化性_______(填“强”或“弱”),这是由于_____________.
已知:下列两个热化学方程式:
Fe(s) + 1/2O2(g)  FeO(s)
FeO(s)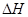 =-272.0KJ/mol
=-272.0KJ/mol
2Al(s) + 3/2O2(g)  Al2O3(s)
Al2O3(s) 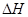 =-1675.7KJ/mol
=-1675.7KJ/mol
则 Al(s)的单质和FeO(s)反应的热化学方程式是______________________________________________________ 。
下图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知B、C、D、E是非金属单质,且在常温常压下都是气体,化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;反应①是化工生产中的一种重要固氮反应。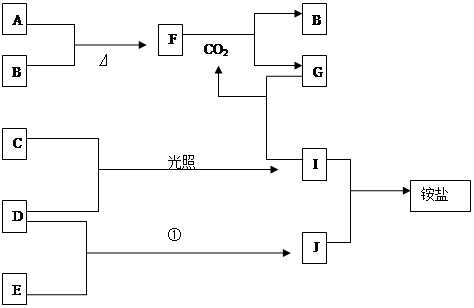
请回答下列问题:
(1)写出下列物质化学式:ABC
(2)写出下列物质间反应的化学方程式
A+B
F+CO2
D+E
I+J
(3)写出下列反应的离子方程式
G+I
写出下列各粒子的化学式
(1)由2个原子组成的具有10个电子的分子阴离子是
(2)由4个原子组成的具有10个电子的分子是阳离子是
(3)由3个原子组成的具有18个电子分子是
(4)由5个原子组成的具有10个电子的阳离子是。
在周期表中氧化性最强的一族元素是,它们原子最外层上的电子数目都是。
该族元素氢化物的通式是,最高价氧化物的通式是。该族元素氢化物的水溶液显,最高价氧化物的水化物显。该族元素随核电荷数的递增,原子半径逐渐,氧化性逐渐。