SO2、NO是大气污染物。吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):
(1)装置Ⅰ中生成HSO3-的离子方程式为 。
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH 的关系如图所示。
①下列说法正确的是 (填字母序号)。
a.pH=8时,溶液中c(HSO3-) < c(SO32-)
b.pH=7时,溶液中c(Na+) =c(HSO3-)+c(SO32-)
c.为获得尽可能纯的NaHSO3,可将溶液的pH控制在4~5左右
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因: 。
(3)装置Ⅱ中,酸性条件下,NO被Ce4+氧化的产物主要是NO3-、NO2-,写出生成NO3-的离子方程式 。
(4)装置Ⅲ的作用之一是再生Ce4+,其原理如下图所示。
①生成Ce4+的电极反应式为 。
②生成Ce4+从电解槽的 (填字母序号)口流出。
(5)已知进入装置Ⅳ的溶液中,NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2 L(用含a代数式表示,计算结果保留整数).
铁及其化合物之间的相互转化可用下式表示: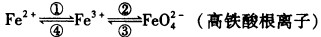
回答下列有关问题:
(1)铁元素位于元素周期表的第四周期第Ⅷ族,原子序数是26,最外层有2个电子。元素铁的原子结构示意图是。
(2)检验硫酸铁溶液中是否存在Fe2+的方法是
(3)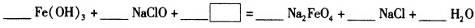
(4)高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾强,其本身在反应中被还原为Fe3+。Na2FeO4之所以能净水,除了能消毒杀菌外,另一个原因是(结合离子方程式说明) 。
钠、镁、铁、铜及其化合物在科研和生产生活中有广泛的应用。
(1)Mg—H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,结构如图所示。电池工作时,正极的电极反应式 。常温下,用该电池电解200mL的饱和硫酸铜溶液(电极为惰性电极),反应时溶液中水的电离平衡移动(填“向左”“向右”或“不”);当消耗24mg金属Mg,电解后溶液的pH=(不考虑溶液的体积变化)。
(2)利用电解法在铁制品上镀铜可以防止铁被腐蚀,以下说法正确的是。
a.电镀时,铜和石墨都可以做阳极,可溶性铜盐作电解质溶液
b.电镀过程中,温度升高,电解反应速率加快
c.电镀过程中,电能全部转化为化学能
d.电镀过程中,铜离子向阴极移动,发生还原反应
(3)NaHS可作为沉淀剂除去溶液中的Cu2+。常温下,NaHS溶液显碱性,原因是(用离子方程式和必要的文字说明)。向含有Cu2+的废水中加入少量NaHS固体,废水溶液的pH(填“增大”“减小”或“不变”)。
菠萝酯是一种食用香料,是化合物甲与苯氧乙酸 发生酯化反应的产物。
发生酯化反应的产物。
(1)甲一定含有的官能团的名称是。
(2)5.8 g甲完全燃烧产生0.3 mol CO2和0.3 mol H2O,甲蒸气对氢气的相对密度是29,甲分子中不含甲基,且为链状结构,其结构简式是。
(3)苯氧乙酸有多种酯类的同分异构体,写出其中能与FeCl3溶液发生显色反应,且苯环上只有两种一硝基取代物的所有可能的同分异构体的结构简式:
。
(4)已知:

菠萝酯的合成路线如下:
①试剂X不能选用的是(选填字母)。
a.CH3COONa溶液 b.NaOH溶液
c.NaHCO3溶液 d.Na
②丙的结构简式是,反应Ⅱ的反应类型是。
③反应Ⅳ的化学方程式是。
硼元素在化学中有很重要的地位。硼的化合物在农业、医药等方面用途很广。请回答下列问题:
(1)写出与B元素同主族的Ga元素的基态原子核外电子排布式________________________________________________________________________。
从原子结构的角度分析,B、N、O元素的第一电离能由大到小的顺序为________。
(2)立方氮化硼可利用人工方法在高温高压条件下合成,属于超硬材料。同属原子晶体的氮化硼(BN)比晶体硅具有更高硬度和耐热性的原因是________________________________________________________________________________________________________________________________________________。
(3)在BF3分子中中心原子的杂化轨道类型是________,SiF4粒子的空间构型是________。又知若有d轨道参与杂化,能大大提高中心原子成键能力。试解释为什么BF3、SiF4水解的产物中,除了相应的酸外,前者生成BF4-后者却是生成SiF62-:________________________________________________________________________
________________________________________________________________________。
(4)科学家发现硼化镁在39 K时呈超导性,在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼相间排列。图是该晶体微观空间中取出的部分原子沿z轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上。根据图示确定硼化镁的化学式为________。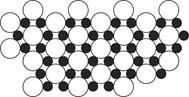
钛和钛的合金已被广泛用于制造电讯器材、人造骨骼、化工设备、飞机等航天航空材料,被誉为“未来世界的金属”。试回答下列问题:
(1)钛有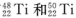 两种原子,它们互称为____。元素在元素周期表中的位置是第_____周期,第____族;基态原子的电子排布式为_____;按电子排布Ti元素在元素周期表分区中属于_____区元素。
两种原子,它们互称为____。元素在元素周期表中的位置是第_____周期,第____族;基态原子的电子排布式为_____;按电子排布Ti元素在元素周期表分区中属于_____区元素。
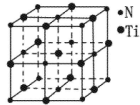
(2)偏钛酸钡在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结构如图所示,它的化学式是______,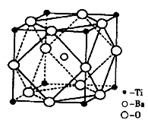
(3)氮化钛(Ti3N4)为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金装饰的替代品。以TiCl4为原料,经过一系列反应,可以制Ti3N4和纳米TiO2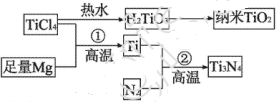 。
。
①Ti3N4中元素的化合价为_____。TiCl4分子中4个氯原子不在同一平面上,则TiCl4的空间构型为______。
②反应①为置换反应、该反应的化学方程式为______。
③纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如下: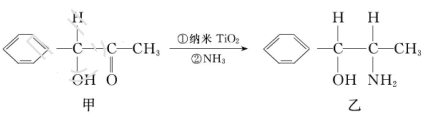
化合物甲的分子中采取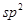 杂化的碳原子个数为_____,化合物乙中采取
杂化的碳原子个数为_____,化合物乙中采取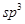 杂化的原子的第一电离能由大到小的顺序为_____。
杂化的原子的第一电离能由大到小的顺序为_____。
④有一种氮化钛晶体的晶胞如图所示,该氮化钛晶胞中含有______个N原子,晶胞中N、Ti之间的最近距离为a pm,则该氮化钛的密度为______g.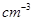 (NA为阿伏加德罗常数的数值,只列算式)。
(NA为阿伏加德罗常数的数值,只列算式)。