(16分)金属铝、铁、铜及其化合物与生产、科研关系密切。
(1)工业上可用铝与软锰矿(主要成分为MnO2)反应冶炼金属锰。用化学方程式表示其冶炼原理________。
(2)工业上,采用石墨、铁棒作为电极,电解除去废水中的CN—(C为+4价。下同),装置如图所示,通电过程中,阴、阳两极均有无色无味的气体产生,阳极区两种离子的放电产物会进一步发生反应,其方程式为C12+CNO—+OH— →□+Cl—+CO32-+H2O(未配平)。
①铁电极应连接直流电源的________________(填写电极名称)。
②上述反应方程式配平后“□”内应填写_______。
③阴极产物有______,阳极上发生的电极反应为2Cl--2e-=Cl2↑和______。
(3)用CuSO4溶液为电解质溶液,进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼。下列说法错误的是___________(填写字母代号)。
a.电能全部转化为化学能
b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属
(4)硫酸铝铵水溶液呈酸性,是因为________(填写离子符号)发生了水解;常温下浓度均为0.1 mol·L-1硫酸铝和硫酸铝铵两种水溶液,c(Al3+)较大的是________(填“硫酸铝铵”或“硫酸铝”)溶液。
二氧化碳捕集、存储和转化是当今化学研究的热点问题之一。
(1)用钌的配合物作催化剂,一定条件下可直接光催化分解CO2,发生反应:2CO2(g)=2CO(g)+O2(g),该反应的ΔH0,ΔS0(选填“>”、“<”或“=”),在低温下,该反应(填“能”或“不能”)自发进行。
(2)CO2转化途径之一是利用太阳能或生物质能分解水制H2,然后将H2与CO2转化为甲醇或其他化学品。你认为该方法需要解决的技术问题有。
a.开发高效光催化剂
b.将光催化制取的氢气从反应体系中有效分离,并与CO2发生催化转化
c.二氧化碳及水资源的供应
在一个体积为2 L的密闭容器中,高温下发生反应:Fe(s)+CO2(g)  FeO(s)+CO(g)。其中CO2、CO的物质的量(mol)随时间(min)的变化关系如图所示。
FeO(s)+CO(g)。其中CO2、CO的物质的量(mol)随时间(min)的变化关系如图所示。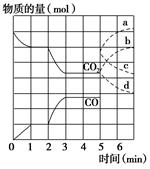
(1)反应在1 min时第一次达到平衡状态,固体的质量增加了3.2 g。用CO2的浓度变化表示的反应速率v(CO2)=________。
(2)反应进行至2 min时,若只改变温度,曲线发生的变化如图所示,3 min时再次达到平衡,则ΔH________0(填“>”、“<”或“=”)。
(3)5 min时再充入一定量的CO(g),平衡发生移动。下列说法正确的是________(填写编号)。
a.v正先增大后减小 b.v正先减小后增大
c.v逆先增大后减小 d.v逆先减小后增大
表示n(CO2)变化的曲线是________(填写图中曲线的字母编号)。
(4)请用固态物质的有关物理量来说明该反应已经达到化学平衡状态:_____________。
一定条件下,体积为1 L的密闭容器中发生如下反应:SiF4(g)+2H2O(g) SiO2(s)+4HF(g) ΔH=+148.9 kJ·mol-1。
SiO2(s)+4HF(g) ΔH=+148.9 kJ·mol-1。
(1)下列各项中能说明该反应已达化学平衡状态的是________(填字母序号)。
a.v消耗(SiF4)=4v生成(HF)
b.容器内气体压强不再变化
c.容器内气体的总质量不再变化
d.HF的体积分数不再变化
(2)反应过程中测定的部分数据如下表(表中t2>t1)所示。
| 反应时间/min |
n(SiF4)/mol |
n(H2O)/mol |
| 0 |
1.20 |
2.40 |
| t1 |
0.80 |
a |
| t2 |
b |
1.60 |
通过a或b的值及化学平衡原理说明t1时反应是否达到化学平衡状态:________。
(3)若只改变一个条件使上述反应的化学平衡常数变大,该反应________(填序号)。
a.一定向正反应方向移动
b.一定向逆反应方向移动
c.一定是减小压强造成的
d.一定是升高温度造成的
e.SiF4的平衡转化率一定增大
一定温度下某容积固定的密闭容器中加入2 mol A和1 mol B,发生如下反应:2A(g)+B(g)  3C(g)+D(s) ΔH=-Q kJ·mol-1(Q>0),当反应达到平衡后,反应放出的热量为Q1 kJ,物质A的转化率为α。请回答下列问题:
3C(g)+D(s) ΔH=-Q kJ·mol-1(Q>0),当反应达到平衡后,反应放出的热量为Q1 kJ,物质A的转化率为α。请回答下列问题:
(1)Q1________Q(填“<”、“>”或“=”),理由是__________________________。
(2)A的转化率α=________(用含Q、Q1的代数式表示);平衡后,若加入少量物质D,A的转化率会________(填“增大”、“减小”或“不变”)。
(3)反应达到平衡后,若升高温度,K________(填“增大”、“减小”或“不变”),混合气体的平均相对分子质量________(填“增大”、“减小”或“不变”)。
(4)维持温度不变,若起始时向容器中加入的物质如下列四个选项,则反应达到平衡后放出的热量仍为Q1 kJ的是(稀有气体不参与反应)________(填字母)。
A.2 mol A、1 mol B、1 mol Ar
B.3 mol C、1 mol D
C.1 mol A、0.5 mol B、1.5 mol C、0.5 mol D
D.2 mol A、1 mol B、1 mol D
已知NO2和N2O4可以相互转化:2NO2(g)  N2O4(g)(正反应为放热反应)。现将一定
N2O4(g)(正反应为放热反应)。现将一定
量NO2和N2O4的混合气体通入一体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如图所示,回答下列问题: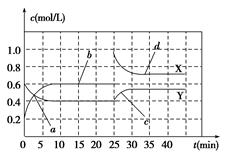
(1)图中共有两条曲线X和Y,其中曲线________表示NO2浓度随时间的变化;a、b、c、d四个点中,表示化学反应处于平衡状态的点是________。
(2)前10 min内用NO2表示的化学反应速率v(NO2)=________mol/(L·min);反应进行至25 min时,曲线发生变化的原因是________。
(3)若要达到与最后相同的化学平衡状态,在25 min时还可以采取的措施是________。
| A.加入催化剂 | B.缩小容器体积 |
| C.升高温度 | D.加入一定量的N2O4 |