已知:常温下浓度为0.1 mol·L-1的下列溶液的pH如表:
| 溶质 |
NaF |
NaClO |
Na2CO3 |
| pH |
7.5 |
9.7 |
11.6 |
下列有关说法正确的是。
A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF
B.若将CO2通入0.1 mol·L-1Na2CO3溶液中至溶液中性,则溶液中2 c (CO32ˉ)+ c (HCO3ˉ)= 0.1 mol·L-1
C.根据上表,水解方程式ClOˉ+ H2O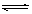 HClO + OHˉ的平衡常数K≈10ˉ7.6
HClO + OHˉ的平衡常数K≈10ˉ7.6
D.向上述NaClO 溶液中通HF气体至恰好完全反应时:c(Na+)>c(Fˉ)>c(H+)>c(HClO)>c(OHˉ)
在恒温、恒容的容器中进行反应:2HI H2+I2(正反应为吸热反应),反应物的浓度由0.1 mol/L降到0.06 mol/L需要20 s,那么由0.06 mol/L降到0.036 mol/L所需时间为
H2+I2(正反应为吸热反应),反应物的浓度由0.1 mol/L降到0.06 mol/L需要20 s,那么由0.06 mol/L降到0.036 mol/L所需时间为
| A.等于10 s | B.等于12 s | C.大于12 s | D.小于12 s |
下列关于平衡常数K的说法中,正确的是
| A.在任何条件下,化学平衡常数是一个恒定值 |
| B.改变反应物浓度或生成物浓度都会改变平衡常数K |
| C.平衡常数K只与温度有关,与反应浓度、压强无关 |
| D.从平衡常数K的大小不能推断一个反应进行的程度 |
反应NH4HS(s) NH3(g)+H2S(g)在某温度下达到平衡,下列各种情况中,不会使平衡发生移动的是
NH3(g)+H2S(g)在某温度下达到平衡,下列各种情况中,不会使平衡发生移动的是
| A.温度、容积不变时,通入SO2气体 |
| B.移走一部分NH4HS固体 |
| C.容积不变,充入氨气 |
| D.保持压强不变,充入氮气 |
热化学方程式C(s)+H2O(g) ="=" CO(g)+H2(g);△H =+131.3kJ/mol表示
| A.碳和水反应吸收131.3kJ能量 |
| B.1mol碳和1mol水反应生成一氧化碳和氢气并吸收131.3kJ热量 |
| C.1mol固态碳和1mol水蒸气反应生成1mol一氧化碳气体和1mol氢气,并吸热131.3kJ |
| D.1个固态碳原子和1分子水蒸气反应吸热131.1kJ |
下列叙述中正确的是
| A.化学反应一定有物质变化,不一定有能量变化 |
| B.化合反应一定是放热反应 |
| C.放热反应不需要加热就一定能发生 |
| D.吸热反应不加热也可能发生 |