高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是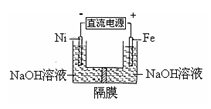
| A.铁是阳极,电极反应为Fe-6e-+4H2O=FeO42-+ 8H+ |
| B.电解时电子的流动方向为:负极→Ni电极→溶液→Fe电极→正极 |
| C.若隔膜为阴离子交换膜,则OH-自右向左移动 |
| D.电解时阳极区pH降低、阴极区pH升高,撤去隔膜混合后,与原溶液比较pH降低(假设电解前后体积变化忽略不计) |
利用右图所示装置进行下列实验,能得出相应实验结论的是( )
| 选项 |
① |
② |
③ |
实验结论 |
 |
| A |
稀硫酸 |
Na2S |
AgNO3与AgCl的浊液 |
Ksp(AgCl)>Ksp(Ag2S) |
|
| B |
浓硫酸 |
蔗糖 |
溴水 |
浓硫酸具有脱水性、氧化性 |
|
| C |
稀盐酸 |
Na2SO3 |
Ba(NO3)2溶液 |
SO2与可溶性钡盐均可以生成白色沉淀 |
|
| D |
浓硝酸 |
Na2CO3 |
Na2SiO3溶液 |
酸性:硝酸>碳酸>硅酸 |
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是
| 选项 |
a中的物质 |
b中的物质 |
c中收集的气体 |
d中的物质 |
| A |
浓氨水 |
CaO |
NH3 |
H2O |
| B |
浓硫酸 |
Na2SO3 |
SO2 |
NaOH溶液 |
| C |
稀硝酸 |
Cu |
NO2 |
H2O |
| D |
浓盐酸 |
MnO2 |
Cl2 |
NaOH溶液 |
光谱研究表明,易溶于水的S02所形成的溶液中存在着下列平衡: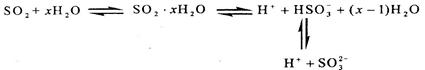
据此,下列判断中正确的是
| A.该溶液中存在着SO2分子 |
| B.该溶液中H+浓度是SO2- 3浓度的2倍 |
| C.向该溶液中加入足量的酸都能放出SO2气体 |
| D.向该溶液中加入过量NaOH可得到Na2SO3 、NaHSO3和NaOH的混合溶液 |
下列叙述正确的是
A.Li在氧气中燃烧主要生成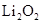 |
B.将SO2通入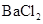 溶液可生成 溶液可生成 沉淀 沉淀 |
| C.将CO2通入次氯酸钙溶液可生成次氯酸 |
| D.将NH3通入热的CuSO4溶液中能使Cu2+还原成Cu |
下列措施不合理的是
| A.用SO2漂白纸浆和草帽辫 |
| B.用硫酸清洗锅炉中的水垢 |
| C.高温下用焦炭还原SiO2制取粗硅 |
| D.用 Na2S作沉淀剂,除去废水中的Cu2+和Hg2+ |