X、Y和W为原子序数依次递增的短周期元素,X和Y同主族,Y和W的气态氢化物具有相同的电子数,X的单质只有氧化性.
(1)写出实验室制取W2反应的离子方程式 .
(2)某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究YX2和W2的性质.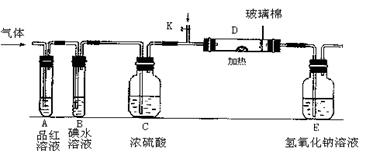
①分别通入YX2和W2,在装置A中观察到的现象是否相同(填“相同”或“不相同”) ;若装置D中装的是铁粉,当通入W2时D中观察到的现象为 ;若装置D中装的是五氧化二钒,当通入YX2时,打开K通入适量X2,化学反应方程式为 ;
②若装置B中装有5.0mL 1.0×10-3mol/L的碘水,当通入足量W2完全反应后,转移了5.0×10-5mol电子,则该反应的化学方程式为 .
(3)某同学将足量的YX2通入一支装有氯化钡溶液的试管,未见沉淀生成,向该试管中加入过量(填字母) ,可以看到白色沉淀生成,其原因为 ______________________(写出其中一种即可).
| A.氨水 | B.稀盐酸 | C.稀硝酸 | D.氯化钙 |
(4)若由元素Y和X组成—2价酸根Z,Z中Y和X的质量比为Y:X=4:3,当W2与含Z的溶液完全反应后,有浅黄色沉淀产生,取上层清液加入氯化钡溶液,有白色沉淀产生.写出W2与Z的溶液完全反应产生浅黄色沉淀的离子方程式 .
已知A、B、C、D、E、F、G七种元素,G原子核外有四个电子层,其余原子至多只有三个电子层,且原子序数依次递增.A、B、F位于周期表的s区,A原子中电子层数和未成对电子数相同,B和A同族且位于A的下一周期,C元素基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,E的基态原子核外成对电子数是未成对电子数的3倍,F与E不同周期且F在其周期中的电负性最大,G原子d轨道有7个电子.
请回答下列问题:
(1)G基态原子的核外电子排布式是;
(2)C、D、E的第一电离能由大到小的顺序是:
(3)下列有关上述元素的说法中,不正确的是(填字母)
a.B单质的熔点在同族单质中最高
b.1molA2E的晶体中含有4mol氢键
c.SiO44-与FE4-互为等电子体
d.C3A6直链分子中C原子采取sp、sp3两种杂化方式
(4)ACD分子中含个σ键。
(5)GCl3能与NH3反应形成一种六配位的配合物,两个氯离子位于外界,则该配合物的化学式为;
(6)C的单质是一种层状结构,B的离子位于C单质的层间、其投影位于层面内六圆环的中央,B和C形成一种化合物,“•”表示B离子的位置,平行四边形表示在此二维图形上画出的一个晶胞.则该化合物的化学式为。
有机物A(C9H10O2)在光照条件下生成的一溴代物B有下列转化关系(无机产略):
已知:①K的一卤代产物只有两种同分异构体;
②当羟基与双键碳原子相连时,易发生下列转化:RCH=CHOH→RCHCHO
请回答下列问题
(1)G中官能团的名称;
(2)上述反应属于取代反应的是;
(3)写出与E互为同分异体且含有两种官能团的有机X的结构式;
(4)写出反应①的化学方程式:;
(5)符合下列条件的A的同分异构体有 种;
I含有苯环
II能发生银镜反应和水解反应
III在稀氢氧化钠溶液中,1mol该能与1molNOH反应
请任写出其中的一种同分异构体的结构简式;
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤,已知
SO2(g)+ O2(g)
O2(g) SO3(g)△H=-98 kJ·mol-1。
SO3(g)△H=-98 kJ·mol-1。
(1)某温度下该反应的平衡常数K= ,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol
,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol
SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时v正v逆(填“<”、“>”或“=”)。
(2)一定温度下,向一带活塞的体积为2 L的密闭容器中充入2.0 mol SO2和1.0 molO2,达到平衡后体积变为1.6 L,则SO2的平衡转化率为。
(3)在(2)中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是(填字母)。
A保持温度和容器体积不变,充入1.0 mol O2
B保持温度和容器内压强不变,充入1.0 mol SO3
C降低温度
D移动活塞压缩气体
(4)若以右图所示装置,用电化学原理生产硫酸,写出通入O2电极的电极反应式为。
(5)为稳定持续生产,硫酸溶液的浓度应维持不变,则通入SO2和水的质量比为。
CuCl2溶液中的铜主要以Cu(H2O)42+、CuCl42-形式存在,它们间有如下转化关系:Cu(H2O)42+(蓝色)+4Cl- CuCl42-(黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电。下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝。回答下列问题:
CuCl42-(黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电。下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝。回答下列问题:
(1)甲电极的电极反应式为_________________。
(2)丙中溶液变蓝是乙电极产物与KI反应导致的,该反应的化学方程式为___。
(3)随电解的不断进行,U型管中溶液的颜色变化为__________;
A.由黄色变为浅蓝色 B.由蓝色变为浅黄色
溶液颜色变化的原因是_________________。
(4)当电解到一定程度,甲电极附近出现蓝色Cu(OH)2絮状物。经测甲电极附近溶液的pH=a,此时甲电极附近溶液中c(Cu2+)=______ mol·L-1。(已知:Cu(OH)2的Ksp=2.2×10-20)
(5)电解较长时间后,丙中溶液的蓝色又会褪去,这是因为乙电极产物进一步将I2氧化为IO3-,该反应的离子方程式为_____________。
I.800℃时,向容积为2L的恒容密闭容器中充入一定量的CO和H2O维持恒温,发生反应CO(g)+H2O(g) H2(g)+CO2(g),反应过���中测定的部分数据见下表:
H2(g)+CO2(g),反应过���中测定的部分数据见下表:
| 反应时间/min |
0 |
2 |
4 |
6 |
| n(CO)/mol |
1.20 |
0.90 |
0.80 |
|
| n(H2O)/ mol |
0.60 |
0.20 |
①反应在2 min内的平均速率为v(H2O)=__________;
②800℃时,化学平衡常数K的值为______________;
③保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率______(填“增大”或“减小”或“不变”)。
④在恒温恒压密闭容器中通入CO和H2O各1 mol发生该反应,当反应达到平衡后,维持温度与压强不变,t1时再通入各1 mol的CO和H2O的混合气体,请在下图中画出正(v正)、逆(v逆)反应速率在t1后随时间t变化的曲线图。
II.实验室中利用复分解反应制取Mg(OH)2。实验数据和现象如下表所示(溶液体积均取用1mL):
①现象III是;
②如果向0.028 mol/L的MgCl2溶液中加入等体积的NaOH溶液,请计算NaOH溶液的浓度至少达到mol/L时,溶液中开始出现白色沉淀(Ksp(Mg(OH)2)= 5.6×10-12)。
③MgCl2溶液和氨水混合后存在下列化学平衡:
Mg2+(aq) + 2NH3·H2O(aq) 2NH4+(aq) + Mg(OH)2(s)该反应化学平衡常数的表达式为K=,列出该反应平衡常数K与Kb(NH3·H2O)、Ksp(Mg(OH)2)的关系式。
2NH4+(aq) + Mg(OH)2(s)该反应化学平衡常数的表达式为K=,列出该反应平衡常数K与Kb(NH3·H2O)、Ksp(Mg(OH)2)的关系式。