25 ℃时某些弱酸的电离平衡常数如下表所示:
| CH3COOH |
HClO |
H2CO3 |
| K(CH3COOH) =1.8×10-5 |
K(HClO) =3.0×10-8 |
K(H2CO3)a1=4.4×10-7 K(H2CO3)a2=4.7×10-11 |
常温下,稀释CH3COOH、HClO两种酸时,溶液的pH随加水量变化的曲线如图所示,下列说法正确的是
A.相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B.图像中a、c两点所处的溶液中 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
C.图像中a点酸的浓度大于b点酸的浓度
D.向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O=2HClO+CO32—
化学反应A2+B2=2AB的能量变化如图所示,则下列说法正确的是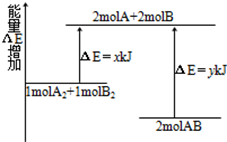
| A.该反应是吸热反应 |
| B.断裂1molA-A键和1molB-B键共放出xkJ能量 |
| C.断裂2molA-B键需要吸收ykJ能量 |
| D.2molAB的总能量高于1molA2和1molB2的总能量 |
对于可逆反应2A(g)+3B(g) 3C(g),在一定条件下,使一定量A和B气体反应,达到平衡状态时,具有的关系是
3C(g),在一定条件下,使一定量A和B气体反应,达到平衡状态时,具有的关系是
A.各物质的量浓度之比为c(A) : c(B) : c(C)="2" : 3 : 3
B.平衡混合物体积是反应开始前的3/5
C.平衡混合物中各物质的量浓度相等
D.单位时间内,若消耗了a mol A物质,则同时也消耗了1.5a mol C物质
食盐(NaCl)是生活中常用的调味品,HCl是胃酸的主要成分,下列关于两种物质的说法正确的是
| A.炒菜时放入食盐并不破坏NaCl中的化学键 |
| B.HCl的电子式是H+ |
| C.NaCl熔化时破坏共价键 |
| D.HCl的结构式是H—Cl |
酒后驾车是引发交通事故的重要原因。交警对驾驶员进行呼气酒精检测的原理是:橙色的酸性K2Cr2C7水溶液遇乙醇迅速生成蓝绿色Cr3+。下列对乙醇的描述与此测定原理有关的是
①乙醇沸点低 ②乙醇密度比水小 ③乙醇有还原性 ④乙醇是烃的含氧衍生物
| A.②④ | B.②③ | C.①③ | D.①④ |
若甲烷与氯气以1:1混合,在光照下反应得到的产物有
①CH3Cl ②CH2Cl2 ③CHCl3 ④CCl4
| A.只有① | B.只有③ |
| C.①②③的混合物 | D.①②③④的混合物 |