工业上用DME法以H2和CO为原料生产甲醚(CH3 OCH3)。其原理是在同一容器中发生如下两个连续反应:
①2H2(g) +CO(g) CH3OH(g)
CH3OH(g)
②2CH3OH(g) CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
当达到平衡时实验数据如表,下列分析正确的是
| 温度(℃) 平衡态 |
260 |
270 |
280 |
290 |
300 |
310 |
320 |
| CO转化率(%) |
92 |
87 |
82 |
80 |
72 |
65 |
62 |
| CH3OCH3产率(%) |
33 |
45 |
77 |
79 |
62 |
58 |
52 |
A.反应①、②均为吸热反应
B.290℃时反应②平衡常数值达到最大
C.平衡时,反应①与②中CH3OH的消耗速率一定相等
D.增大压强能增大CH3OCH3产率
如图所示是101kPa时氢气在氯气中燃烧生成氯化氢气体的能量变化,则下列有关说法中不正确的是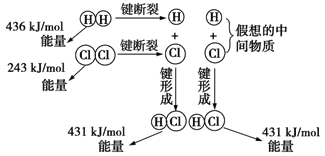
| A.1 mol H2中的化学键断裂时需要吸收436 kJ能量 |
| B.2 mol HCl分子中的化学键形成时要释放862 kJ能量 |
C.此反应的热化学方程式为H2(g)+Cl2(g)  2HCl(g) ΔH="+183" kJ·mol-1 2HCl(g) ΔH="+183" kJ·mol-1 |
D.此反应的热化学方程式为1/2H2(g)+1/2Cl2(g)  HCl(g) ΔH=-91.5 kJ·mol-1 HCl(g) ΔH=-91.5 kJ·mol-1 |
下列有关金属腐蚀与防护的说法正确的是
| A.纯银器表面在空气中因电化学腐蚀渐渐变暗 |
| B.当镀锡铁制品的镀层破损时,镶层仍能对铁制品起保护作用 |
| C.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 |
| D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g);△H=" +" 49.0 kJ·mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);△H=-192.9 kJ·mol-1
下列说法正确的是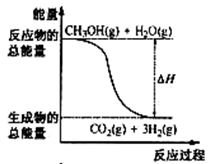
| A.CH3OH的燃烧热为192.9 kJ·mol-1 |
| B.反应①中的能量变化如上图所示 |
| C.CH3OH转变成H2的过程一定要吸收能量 |
| D.根据②推知反应:CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g) 的△H>-192.9kJ·mol-1 |
Cl2可用来消灭田鼠,使用时可将Cl2通过管子灌入洞中,这是利用Cl2下列性质中的
| A.黄绿色 | B.密度比空气大 |
| C.有毒 | D.较易液化 |
巴豆酸的结构简式为 CH3—CH="CH—COOH" ,现有
①氯化氢
②溴水
③纯碱溶液
④2-丁醇
⑤酸性高锰酸钾溶液
试根据巴豆酸的结构特点,判断在一定的条件下,能与巴豆酸反应的物质是
| A.只有②④⑤ | B.只有①③④ |
| C.只有①②③④ | D.全部 |