下列判断正确的是
A.Na2S2O3溶液中加入稀硫酸的离子方程式为:2S2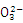 +4H+ +4H+ S S + 3S↓+ 2H2O + 3S↓+ 2H2O |
B.用TiCl4制备TiO2的反应可表示为:TiCl4+(x+2)H2O(过量)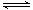 TiO2·xH2O↓+4HCl TiO2·xH2O↓+4HCl |
C.滴加甲基橙试液后呈红色的溶液中可以大量共存: Na+、 C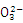 、 K+、 Al 、 K+、 Al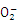 |
| D.25℃时,pH=12的NaOH溶液中含有OH-的数目为0.01NA |
在实验室不能用玻璃试剂瓶盛放的试剂是
A.氢氟酸 B.饱和碳酸钠溶液 c.浓硫酸 D.氢氧化钠溶液
下列过程只涉及物理变化的是
| A.伐薪烧炭 | B.酿酒成醋 | C.滴水成冰 | D.百炼成钢 |
下列污染现象主要与SO2有关的是
| A.臭氧空洞 | B.雾霾 | C.温室效应 | D.酸雨 |
手机芯片是一种在半导体材料上集合多种电子元器件的电路模块。下列可用作半导体材料的是
| A.铝 | B.硅 | C.碳 | D.铁 |
已知下表均为烷烃分子的化学式,且它们的一氯取代物只有一种,
| 1 |
2 |
3 |
4 |
5 |
6 |
7… |
| CH4 |
C2H6 |
C5H12 |
C8H18] |
C17H36 |
… |
… |
则第7项烷烃分子的化学式为()
A.C26H54 B.C53H108 C.C54H110 D.C55H112