氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强。25℃时氯气-氯水体系中存在以下平衡关系:
Cl2(g) 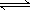 Cl2(aq) K1=10-1.2
Cl2(aq) K1=10-1.2
Cl2(aq)+ H2O 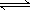 HClO + H+ +Cl- K2=10-3.4
HClO + H+ +Cl- K2=10-3.4
HClO 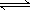 H+ + ClO- Ka=?
H+ + ClO- Ka=?
其中,Cl2(aq)、HClO和ClO-分别在三者中所占
的物质的量分数(α)随pH变化的关系如图所示。
下列表述正确的是
A.Cl2(g)+ H2O 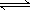 2H+ + ClO-+ Cl- ,K=10-10.9 2H+ + ClO-+ Cl- ,K=10-10.9 |
| B.pH=7.5时,用氯处理饮用水体系中,c(Cl-) + c(HClO) =c(H+)-c(OH-) |
| C.用氯处理饮用水时,pH=6.5时杀菌效果比pH=4.5时好 |
| D.氯处理饮用水时,在夏季的杀菌效果比在冬季好 |
在一定温度下的定容密闭容器中,下列情况表明反应A(s)+2B(g) C(g)+D(g) 已达到反应限度的是
C(g)+D(g) 已达到反应限度的是
| A.混合气体的密度保持不变 | B.有1mol C生成的同时有1mol D生成 |
| C.混合气体的总物质的量保持不变 | D.有1 mol A生成的同时有1mol C消耗 |
无色透明溶液中放入铝片,产生大量氢气,该溶液中肯定可以大量存在的离子是
| A.Fe2+、K+、Cl-、NO3- | B.Na+、K+、CO32-、Cl- |
| C.Na+、Al3+、NO3-、SO42- | D.K+、Na+、Cl-、Br- |
下列关于乙醇和乙酸两种物质的说法不正确的是
| A.都能发生取代反应 | B.都能使紫色石蕊试液变红 |
| C.都能发生酯化反应 | D.都能和金属钠反应生成H2 |
下列离子方程式中,正确的是
| A.在氯化铝溶液中加入过量氨水:Al3+ + 3OH- = Al(OH)3↓ |
| B.在硝酸银溶液中滴入氯化钠溶液:Ag+ + Cl- ="" AgCl↓ |
| C.金属钠与水反应: Na + 2H2O = Na+ + 2OH - + H2↑ |
| D.铁与稀盐酸反应: 2Fe + 6H+ = 2Fe3+ + 3H2↑ |
下列物质中,属于高分子化合物的是
①蛋白质②氨基酸③油脂④淀粉⑤氯乙烯⑥纤维素⑦聚乙烯
| A.只有①⑦ | B.除外②都是 | C.只有①④⑥⑦ | D.只有①③ |