下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。
(1)装置A是氯气的发生装置,其中盛放浓盐酸的仪器名称是____________,请写出该反应相应的化学方程式: 。
(2)装置B中饱和食盐水的作用是 ;同时装置B也是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象: 。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ处依次放入物质的组合应是 (填字母编号)。
| 编号 |
Ⅰ |
Ⅱ |
Ⅲ |
| a |
干燥的有色布条 |
碱石灰 |
湿润的有色布条 |
| b |
干燥的有色布条 |
无水硫酸铜 |
湿润的有色布条 |
| c |
湿润的有色布条 |
浓硫酸 |
干燥的有色布条 |
| d |
湿润的有色布条 |
无水氯化钙 |
干燥的有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘单质的氧化性。反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是 ,该现象 (填“能”或“不能”)说明溴单质的氧化性强于碘,原因是 。
(5)装置F的作用是,其烧杯中的溶液不能选用下列中的 (填字母编号)。
a.饱和NaOH溶液 b.饱和Ca(OH)2溶液
c.饱和Na2SO3溶液 d.饱和Na2CO3溶液[来
用氯化铁浸出重铬酸钾(K2Cr2O7)滴定法测定钛精粉试样中单质铁的质量分数[w(Fe)],实验步骤如下:
步骤1:称取试样0.100 g于250 mL洗净的锥形瓶中。
步骤2:加入FeCl3溶液100 mL,迅速塞上胶塞,用电磁搅拌器搅拌30 min。
步骤3:过滤,用水洗涤锥形瓶和滤渣各3~4次,洗液全部并入滤液中。
步骤4:将滤液稀释至500 mL,再移取100 mL稀释液于锥形瓶中,加入20 mL硫酸和磷酸的混合酸,加0.5%二苯胺磺酸钠指示剂4滴。
步骤5:以K2Cr2O7标准溶液滴定至出现明显紫色为终点。发生的反应为Cr2O72—+6Fe2++14H+=2Cr3++6Fe3++7H2O。
步骤6:重复测定两次。
步骤7:数据处理。
(1)步骤2中加入FeCl3溶液后锥形瓶中发生反应的离子方程式为________________,迅速塞上胶塞的原因是______________________________
(2)步骤3中判断滤纸上残渣已洗净的方法是_____________________________
(3)实验中需用到100 mL浓度约为0.01 mol·L-1K2Cr2O7标准溶液,配制时用到的玻璃仪器有________________。称量K2Cr2O7固体前应先将其烘干至恒重,若未烘干,对测定结果的影响是________(填“偏高”、“偏低”或“无影响”);滴定时,K2Cr2O7溶液应置于________(填仪器名称)中。
(4)科研人员为确定FeCl3溶液的最佳浓度,选用100 mL不同浓度的FeCl3溶液(FeCl3溶液均过量)溶解同一钛精粉试样,其余条件控制相同,得到测定结果如图所示。则FeCl3溶液的浓度[用ρ(FeCl3)表示]范围应为________g·L-1,浓度过低或过高时测定结果偏低的原因分别是_________________________。
某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示: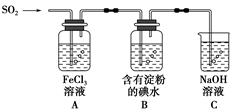
(1)SO2气体还原Fe3+的产物是________(填离子符号),参加反应的SO2和Fe3+的物质的量之比是________。
(2)下列实验方案适用于在实验室制取所需SO2的是________。
A.Na2SO3溶液与HNO3 B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧D.铜与热浓H2SO4
(3)装置C的作用是____________________________________。
(4)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、过滤、自然干燥,在这一系列操作中没有用到的仪器有________(填序号)。
A.蒸发皿 B.石棉网
C.漏斗 D.烧杯 E.玻璃棒 F.坩埚
(5)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入酸性KMnO4溶液,紫红色褪去。
方案②:往第二份试液中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:往第三份试液中加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是________,原因是__________________________
______________________________________________。
(6)能表明I-还原性弱于SO2的现象是_____________________________
___________________________________________。
某种粗盐中含有泥沙、Ca2+、Mg2+、Fe3+、SO等杂质。某同学在实验室中设计了用这种粗盐制备精盐的方案如下(用于沉淀的试剂稍过量):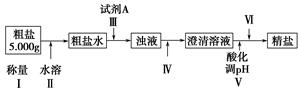
请回答以下问题:
(1)为操作Ⅳ选择所需仪器(用标号字母填写):________。
| A.烧杯 | B.试管 | C.玻璃棒 | D.分液漏斗 E.漏斗 F.酒精灯 |
G.蒸发皿
(2)操作Ⅲ中常用Na2CO3溶液、NaOH溶液、BaCl2溶液作为除杂试剂,则加入除杂试剂的顺序为:NaOH溶液→________→________。
(3)操作Ⅲ中,判断加入BaCl2已过量的方法是_________________________。
(4)操作Ⅴ应选择的酸是________,若将操作Ⅴ与操作Ⅳ的先后顺序对调,将会对实验结果产生的影响是__________________________________________。
(5)操作Ⅵ是________(选择合理操作的名称,用标号字母按操作先后顺序填写)。
a.过滤、洗涤 b.蒸发、浓缩 c.萃取、分液 d.冷却、结晶
制备氮化镁的装置示意图如下: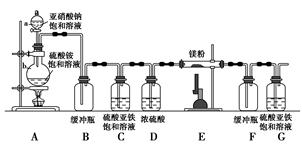
回答下列问题:
(1)检查装置气密性的方法是________________________________,
a的名称是________,b的名称是________;
(2)写出NaNO2和(NH4)2SO4反应制备氮气的化学方程式___________________;
(3)C的作用是______________________________________________________,
D的作用是____________________________________________________,
是否可以把C和D的位置对调并说明理由_____________________________;
(4)写出E中发生反应的化学方程式_________________________________;
(5)请用化学方法确定是否有氮化镁生成,并检验是否含有未反应的镁,写出实验操作及现象____________________________________________________。
碱式碳酸铜是一种化工原料,化学式用mCu(OH)2·nCuCO3表示。实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
Ⅰ.废铜屑制硝酸铜
方案1:将铜屑在空气中充分灼烧,残留固体溶于稀硝酸;
方案2:如图1(夹持仪器已省略)。将浓硝酸缓慢加到废铜屑中(废铜屑过量),充分反应后过滤,得到硝酸铜溶液。
方案3:将方案2中浓硝酸换成稀硝酸,其他不变。
Ⅱ.碱式碳酸铜的制备
①向大试管中加入碳酸钠溶液和硝酸铜溶液
②水浴加热至70 ℃左右
③用0.4 mol·L-1的NaOH溶液调节pH至8.5,振荡、静置、过滤
④用热水洗涤、烘干,得到碱式碳酸铜产品
请回答下列问题:
(1)按方案1实验,必须选择的下列仪器有________(填序号)。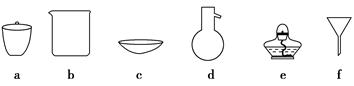
(2)图2中能分别替代图1中B和C装置的是________(填装置序号)。
(3)已知:NO+NO2+2NaOH===2NaNO2+H2O;2NO2+2NaOH===NaNO3+NaNO2+H2O,NO不能单独与NaOH溶液反应,实验结束时,如何操作才能使装置中的有毒气体被NaOH溶液完全吸收?__________________________。
(4)步骤④中洗涤的目的是______________________________________。
(5)步骤③过滤后的滤液中含有CO32—,检验CO32—的方法是_________________________________________________________。
(6)测定碱式碳酸铜组成的方法主要有两种:
方法1 灼烧法:取34.6 g纯净物mCu(OH)2·nCuCO3,在硬质试管里灼烧,将气体产物依次通入足量的浓硫酸、足量的碱石灰中,完全吸收后浓硫酸净增1.8 g,碱石灰净增8.8 g。
方法2 还原法:在氢气中加强热,测反应前后固体的质量。
①利用上述数据推算碱式碳酸铜的化学式_____________________。
②配平化学方程式:mCu(OH)2·nCuCO3+________H2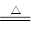 ________Cu+________CO2↑+________H2O
________Cu+________CO2↑+________H2O