[物质结构与性质]过渡元素铁可形成多种配合物,如:[Fe(CN)6]4-、Fe(SCN)3等。
(1)Fe2+基态核外电子排布式为 。
(2)科学研究表明用TiO2作光催化剂可将废水中CN-转化为OCN-、并最终氧化为N2、CO2。OCN-中三种元素的电负性由大到小的顺序为 。
(3)与CN-互为等电子体的一种分子为 (填化学式);1mol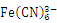 中含有σ键的数目为 。
中含有σ键的数目为 。
(4)铁的另一种配合物Fe(CO)5熔点为-20.5℃,沸点为103℃,易溶于CCl4,据此可以判断Fe(CO)5晶体属于 (填晶体类型)。
(5)铁铝合金的一种晶体属于面心立方结构,其晶胞可看成由8个小体心立方结构堆砌而成。已知小立方体如图所示。该合金的化学式为 。
下列分子式表示的物质一定是纯净物的是 ( )
| A. C5H10 | B. CH4 | C. C2H4O2 | D. C2H4Cl2 |
NaH与水反应的化学方程式为NaH+H2O==NaOH+H2↑,在该反应中NaH()
| A.是氧化剂 | B.是还原剂 |
| C.既是氧化剂又是还原剂 | D.既不是氧化剂又不是还原剂 |
下列叙述正确的是()
| A.直径介于 1nm ~ 100nm 之间的微粒称为胶体 |
| B.电泳现象可证明胶体属于电解质溶液 |
| C.胶体粒子很小,可以透过半透膜 |
| D.利用丁达尔效应可以区别溶液与胶体 |
下列溶液中的c (Cl -)与50mL 1mol·L-1氯化铝溶液中的c (Cl -)相等的是()
| A.150mL1mol·L-1氯化钠溶液 | B.75mL2mol·L-1氯化铵溶液 |
| C.150mL3mol·L-1氯化钾溶液 | D.75mL2mol·L-1氯化钡溶液 |
NA为阿伏加德罗常数,下列叙述错误的是
| A.标准状况下,1molSO3的体积约为22.4L |
| B.100mL0.10 mol·L-1AlCl3溶液中,Cl-的数目为0.03NA |
| C.18g水中,电子的数目为10NA |
| D.3molCu与稀硝酸完全反应,被还原的NO3-数目为2NA |