(15 分)二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂,答下列问題:
(1)工业上可用KC1O3与Na2SO3在H2SO4存在下制得ClO2,该反应氧化剂与还原剂物质的量之比
为 。
(2)实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:


①电解时发生反应的化学方程式为 。
②溶液X中大量存在的阴离子有__________。
③除去ClO2中的NH3可选用的试剂是 (填标号)。
a.水 b.碱石灰C.浓硫酸 d.饱和食盐水
(3)用下图装置可以测定混合气中ClO2的含量:
Ⅰ.在锥形瓶中加入足量的碘化钾,用50 mL水溶解后,再加入 3 mL 稀硫酸:
Ⅱ.在玻璃液封装置中加入水.使液面没过玻璃液封管的管口;
Ⅲ.将一定量的混合气体通入锥形瓶中吸收;
Ⅳ.将玻璃液封装置中的水倒入锥形瓶中:
Ⅴ.用0.1000 mol·L-1硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O32-=2I-+S4O62-),指示剂显示终点时共用去20.00 mL硫代硫酸钠溶液。在此过程中:
①锥形瓶内ClO2与碘化钾反应的离子方程式为 。
②玻璃液封装置的作用是 。
③V中加入的指示剂通常为 ,滴定至终点的现象是 。
④测得混合气中ClO2的质量为 g.。
(4)O2处理过的饮用水会含有一定最的亚氯酸盐。若要除去超标的亚氯酸盐,下列物庾最适宜的是_______填标号)。
a.明矾 b.碘化钾 c.盐酸 d.硫酸亚铁
合金已成为飞机制造、化工生产等行业的重要材料。研究性学习小组的同学,为测定某含镁3%~5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究。填写下列空白。
〖实验方案一〗将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。实验中发生反应的化学方程式是
〖实验步骤〗
(1)称取5.4 g铝镁合金粉末样品,溶于VmL 2.0 mol/LNaOH溶液中,充分反应。则NaOH溶液的体积V ≥ 。
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将
(填“偏高”、“偏低”或“无影响”)。
〖实验方案二〗将铝镁合金与足量稀硫酸溶液反应,测定生成气体在通常状况(约20℃,1.01×105Pa)的体积。
〖问题讨论〗
(3)同学们拟选用下列实验装置完成实验: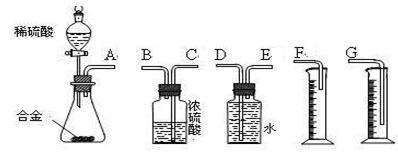
①你认为最简易的装置其连接顺序是(填接口字母,可不填满):
A接( )( )接( )( )接( )
②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶。请你帮助分析原因。 。
③实验结束时,在读取测量实验中生成氢气的体积时,你认为合理的是 。
| A.待实验装置冷却后再读数 |
| B.上下移动量筒F,使其中液面与广口瓶中液面相平 |
| C.上下移动量筒G,使其中液面与广口瓶中液面相平 |
| D.视线与凹液面的最低点水平,读取量筒中水的体积 |
某化学小组采用类似制乙酸乙酯的装置(如下图),以环己醇制备环己烯: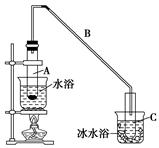
已知: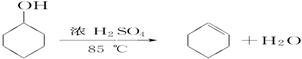
| 密度(g/cm3) |
熔点(℃) |
沸点(℃) |
溶解性 |
|
| 环己醇 |
0.96 |
25 |
161 |
能溶于水 |
| 环己烯 |
0.81 |
-103 |
83 |
难溶于水 |
(1)制备粗品
将12.5 mL环己醇加入试管A中,再加入1 mL浓硫酸,摇
匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是________,导管B除了导气外还具有的作用是________。
②试管C置于冰水浴中的目的是________________________________________。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。先加入Na2CO3溶液,振荡、静置、分层,环己烯在________层(填“上”或“下”),分液后用水洗涤。
②再将环己烯按下图装置蒸馏,冷却水从________口进入(填“g”或“f”)。蒸馏时要加入生石灰,目的是________________________________________。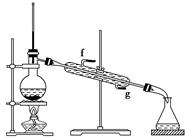
③实验制得的环己烯精品质量低于理论产量,可能的原因是________。
A.蒸馏时从70 ℃开始收集产品
B.环己醇实际用量多了
C.制备粗品时环己醇随产品一起蒸出
实验室制硝基苯的主要步骤如下
(1)配制一定比例的浓硫酸与浓硝酸的混合酸,加入反应器中。
(2) 向室温下的混合酸中逐滴加入一定量的苯,充分振荡,混合均匀
(3)在50摄氏度到60摄氏度下发生反应,直至反应结束。
(4)除去混合酸后,粗产品依次用蒸馏水和5%的NaOH溶液洗涤,最后再用蒸馏水洗涤。
(5)将用无水CaCl2干燥后的粗硝基苯进行蒸馏,得到纯硝基苯。
填写下列空白:
(1)配制一定比例浓硫酸与浓硝酸混合酸时,操作注意事项是
(2)在步骤3中,为了使反应在50摄氏度到60摄氏度下进行,常用的方法是
(3)步骤4中洗涤,分离出硝基苯应使用的仪器是
(4)步骤4中粗产品用5%的NaOH 溶液洗涤的目的是
(5)纯硝基苯是无色,密度比水(填小或大)。具有气味的油状液体
在实验室里可用右图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。 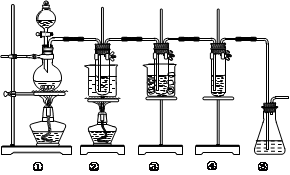
图中:①为氯气发生装置;②的试管里盛有15 mL 30% KOH溶液,并置于热水浴中;③的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置。
请填写下列空白:
⑴制取氯气时,在烧瓶里加入一定量的二氧化锰,通过________(填写仪器名称)向烧瓶中加入适量的浓盐酸。实验室制Cl2的化学方程式;实验时为了除去氯气中的HCl气体,可在①与②之间安装盛有_______(填写下列编号字母)的净化装置。
| A.碱石灰 | B.氢氧化钠溶液 | C.饱和食盐水 | D.浓硫酸 |
⑵ 如果将过量二氧化锰与20 mL 12 mol·L-1的浓盐酸混合加热,充分反应后生成的氯气明显少于0. 06 mol。其主要原因有:
①_______________________________________________,
②__________________________________________________________________________。
⑶ 比较制取氯酸钾和次氯酸钠的条件,二者的差异是
①;
②。
(4)反应完毕经冷却后,②的试管中有大量晶体析出。
①下图中符合该晶体溶解度曲线的是_______(填写编号字母);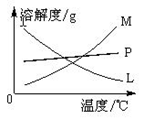
②从②的试管中分离出该晶体的方法是__________(填写实验操作名称)。
⑷ 实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白。
| 实验现象 |
原因 |
| 溶液最初从紫色逐渐变为_______色 |
氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 |
______________________________________ |
| 然后溶液从无色逐渐变为_______色 |
______________________________________ |
某同学想利用原电池反应检测Zn和Cu的金属活动性顺序。请你帮他选择适宜的材料和试剂设计一个原电池,并完成下列实验报告:
实验目的:探究Zn和Cu的金属活动性顺序
(1)电极 材料:正极:;负极:;
电解质溶液:。
(2)写出电极反应式:
正极:;负极:。
(3)实验现象:
(4)实验结论: