某食盐样品中含有少量沙土、氯化钙和氯化镁。以下是除去食盐样品中沙土、氯化钙和氯化镁的实验流程: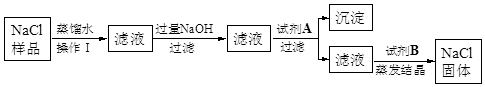
根据流程图回答:
(1)操作Ⅰ的名称是 ,加入的试剂A是 ,沉淀是 ;
(2)写出NaOH与杂质反应的化学方程式
(3)加入试剂B的目的是 ;
(4)蒸发结晶时用到玻璃棒的作用是
氢化钙(CaH2)固体是一种储氢材料,登山运动员常用其作能源提供剂。
【查阅资料】
①碱石灰是氧化钙和氢氧化钠的固体混合物.
②钙和氢化钙都能与水反应,均生成氢氧化钙和氢气.
【氢化钙的制备】
氢化钙通常用氢气与钙加热制得.某化学兴趣小组设计的制取装置如图所示(图中固定装置省略).
(1)装置A中制取氢气反应的化学方程式是 .
(2)装置B的作用是 .
(3)装置D的作用是 .
(4)装置C中制取氢化钙的化学方程式是 .
【样品成分的猜想】通过上述方法制得的氢化钙样品的成分有下列两种猜想:
猜想一:全部是氢化钙;猜想二: .
【设计实验】现有2.1g氢化钙样品,请设计实验验证猜想二是否成立 (要求操作、数据和结论).
根据下图回答有关问题.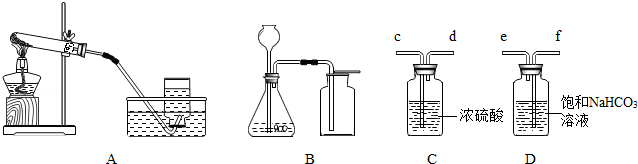
(1)实验室利用A装置制取氧气,当伸入集气瓶的导管口气泡 放出时,才可以收集氧气.用收集到的氧气完成硫粉燃烧实验后,还需向集气瓶内加入适量氢氧化钠溶液,目的是 .
(2)实验室利用B装置制取二氧化碳,该反应的化学方程式是 .制得的二氧化碳中含有 和氯化氢等杂质气体,可分别用C、D装置除去,则C、D的连接顺序是:混合气体→ (用接口字母表示).
(4)将纯净的二氧化碳气体通入盛有蒸馏水的洗气瓶,一段时间后,测得溶液的pH (填“>”、“<”或“=”)7,对该现象的合理解释是 (用化学方程式表示).
金属是人类生活中的常用的材料.
(1)下列生活用品中,主要利用金属导热性的是 (填字母序号).
(2)工业上用赤铁矿(主要成分是氧化铁)冶炼铁的化学方程式是 .
(3)现有锌片、铜片、稀硫酸、硫酸锌溶液和硫酸铜溶液5种物质,某同学欲探究锌和铜的金属活动性顺序,选择的一组试剂是 ,其现象是 .
(4)该同学查阅资料得知,铜锈的主要成分是碱式碳酸铜【Cu2(OH)2CO3】,他以铜锈为原料设计并完成如下实验(杂质不与稀硫酸反应,且不含铜元素.图中部分物质略去).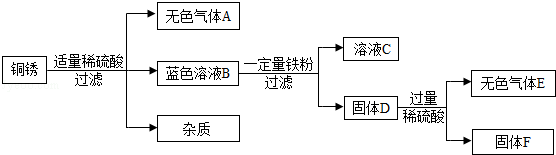
①溶液C中所含的溶质是 .
②已知铜锈中Cu2(OH)2CO3的质量分数是10%,固体F的质量是1.28g,则铜锈中含Cu的质量分数是
(结果精确至0.1%).
水是一种重要的自然资源,是生活、生产必不可少的物质.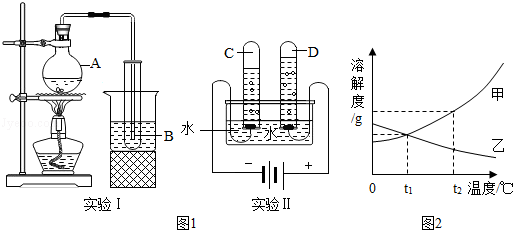
(1)如图1所示,实验I是制备蒸馏水的装置,实验Il是电解水的装置.
①实验Ⅰ中水从A转移到B中,体现分子的性质是 .
②实验Ⅱ中反应的化学方程式是 .试管D中产生的气体可以使带火星的木条复燃,当试管D中气体的体积为n时,试管C中气体体积约为 .
(2)图2是甲、乙两种固体物质的溶解度曲线.
①t2℃时,甲、乙两种物质的饱和溶液所含溶质的质量相同,则溶液质量的大小关系为甲 乙(填“>”、“<”或“=”).
②将甲物质的不饱和溶液变为饱和溶液,下列有关说法正确的是 (填字母序号).
A.溶剂的质量一定变小 B.溶质的质量可能不变学科王 C.溶质的质量分数一定变大 D.溶液的质量一定变大
E.该饱和溶液还可以溶解其它物质
(3)下图是硝酸钾的溶解度曲线.某同学进行了如下实验,得到相应的溶液①~⑤.下列说法正确的是 (填字母序号).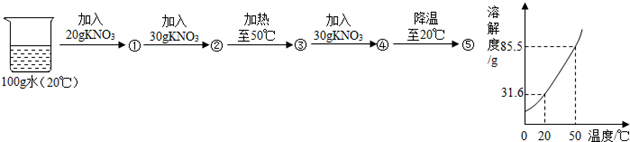
A.④→⑤可析出53.9g KNO3晶体
B.②③⑤中溶质的质量分数相等
C.①③④均为不饱和溶液
D.保持温度不变,若在④中加入6g KNO3固体可得到饱和溶液.
“凤凰”号火星探测器曾向地面发回的数量堪称史无前例的数据、“好奇”号火星车完成的火星物质成分分析,都为人类探索火星提供了宝贵的资料.
(1)“凤凰”号发回的照片上显示,火星上存在液态水.下列示意图可表示构成水的微粒的是 (填字母序号).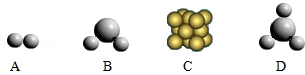
(2)“好奇号”火星车测得火星土壤中含硫和氯,这里的“硫”、“氯”是指 (填字母序号).
A.分子 B.原子 C.元素 D.离子
(3)火星大气各成分含量如图所示,其中与地球大气所含成分相同的物质是 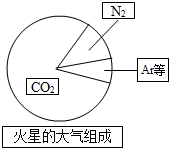
(4)火星上含有丰富的二氧化碳和镁资源.镁能在二氧化碳中燃烧放出大量的热,同时生成氧化镁和碳,该反应的化学方程式是 .
(5)火星的土壤呈弱碱性.如果火星具备作物生长的条件,下表所列作物较适宜在火星种植的有 (填字母序号).
| 作物 |
A.芦笋 |
B.草莓 |
C.萝卜 |
D.马铃薯 |
| 适宜生长的pH |
5.5~7.8 |
5.5~6.5 |
5.0~8.0 |
5.6~6.0 |