下表为元素周期表的一部分,列出了7种元素在元素周期表中的位置:
| 族 周 期 |
ⅠA |
|
|
|
0 |
||||
| |
|||||||||
| 1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
|
| 2 |
|
|
|
② |
③ |
④ |
|
|
|
| 3 |
⑤ |
|
⑥ |
|
|
|
⑦ |
|
|
请按要求回答下列问题(用化学用语回答):
(1)写出④的单核离子结构示意图: ,③与①所形成的化合物的结构式为: 。
(2)7种元素中,原子半径最小的是: (填元素符号)。
(3)用电子式表示元素②与④最高价化合物的形成过程: 。
(4)元素⑤和元素⑥最高价氧化物的水化物相互反应的化学方程式为: 。
(5)元素④的氢化物与元素⑦的单质反应的离子方程式为: 。
可逆反应: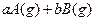

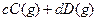 ,取
,取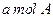 和
和 置于V L容器内。1分钟后,测得容器内A的浓度为
置于V L容器内。1分钟后,测得容器内A的浓度为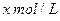 ,这时B的浓度为_______ ______
,这时B的浓度为_______ ______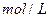 ,C的浓度为__________
,C的浓度为__________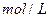 。这段时间内反应的平均速率若以物质A的浓度变化来表示,应为______ _____。
。这段时间内反应的平均速率若以物质A的浓度变化来表示,应为______ _____。
下列是由A→D的反应路线图
(1)写出反应①的化学方程式。
(2)三步反应中属于取代反应的有(填反应序号)。
(3)D有多种同分异构体,其中含有 基团的同分异构体有(不含D)。
基团的同分异构体有(不含D)。
a.5种 b.6种 c.7种 d.8种
用丙醛(CH3-CH2-CHO)为原料通过三步反应得到聚丙烯,写出反应过程中发生的反应方程式:
(1)。
(2)。
(3)。
(1)A分子式为C3H6O,A能发生银镜反应,写出A发生银镜反应的方程式
(2)B的分子式是C4H9Cl,它与氢氧化钠的醇溶液共热,能生成两种可能的有机产物,则B的结构简式是。
(3)阿司匹林学名为乙酰水杨酸,结构简式为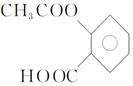 ,写出其与足量的NaOH 溶液共热反应的方程式。
,写出其与足量的NaOH 溶液共热反应的方程式。
有机物A的结构简式是 ,它可以通过
,它可以通过 不同的反应得到下列物质:
不同的反应得到下列物质:
(1)A中官能团的名称是:。
(2)写出由A制取B的化学方程式:
。
(3)写出A制取C、D两种物质的有机反应类型:
A→C:A→D: