中和热是在稀溶液中,强酸、强碱发生中和反应生成1 mol水时放出的热量,中和热为57.3 kJ/mol。下列热化学方程式中正确的是
| A.HNO3(aq)+KOH(aq)===H2O(l)+KNO3(aq) ΔH>-57.3 kJ/mol |
| B.HNO3(aq)+NH3·H2O(aq)===H2O(l)+NH4NO3(aq)ΔH<-57.3 kJ/mol |
| C.CH3COOH(aq)+KOH(aq)===H2O(l)+CH3COOK(aq) ΔH<-57.3 kJ/mol |
| D.CH3COOH(aq)+NH3·H2O(aq)===H2O(l)+CH3COONH4(aq) ΔH>-57.3 kJ/mol |
下列除杂质的方法不可行的是
| A.加入新制的生石灰,然后加热蒸馏,可以除去乙醇中少量的水 |
| B.通过装有浓酸性高锰酸钾溶液的洗气瓶,可以除去甲烷中的乙烯 |
| C.用苯,通过分液的方法,可以除去溴苯中的溴 |
| D.用氢氧化钠溶液,通过分液的方法,可以除去苯中的乙酸 |
下列说法不正确的是
| A.化学反应除了生成新物质外,还伴随着能量的变化 |
| B.放热反应不需要加热就可以发生 |
| C.反应条件是加热的反应都是吸热反应 |
| D.化学反应放热还是吸热,取决于生成物具有的总能量和反应物具有的总能量 |
下列有关能量转化的认识不正确的是
| A.植物的光合作用使太阳能转化为化学能 |
| B.人类使用照明设备主要是将电能转化为光能 |
| C.燃料燃烧时只是将化学能转化为热能 |
| D.生物体内的化学变化过程在能量上比在体外发生的一些能量转化更合理、有效 |
下列各组中的离子,能在溶液中大量共存的是
A.Ag+、Al3+、NO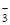 、H+ 、H+ |
B.H+ 、Na+、CO 、Cl- 、Cl- |
C.K+、H+、SO 、OH- 、OH- |
D.Ba2+、Na+、Cl-、SO |
巴豆酸的结构简为CH3CH=CHCOOH现有:①氢气,②溴水,③小苏打溶液,④酸性KMnO4,⑤乙醇,试根据其结构特点,判断在一定条件下能与巴豆酸反应的物质组合是
| A.只有②④⑤ | B.只有①③④ |
| C.只有①②③ | D.都可以 |