( 12分)2SO2(g)+O2(g) 2SO3(g)反应过程的能量变化如图所示,已知1 mol SO2(g) 被氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。
2SO3(g)反应过程的能量变化如图所示,已知1 mol SO2(g) 被氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。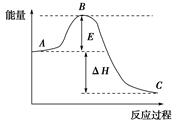
回答下列问题:
(1)E的大小对该反应的反应热有无影响? 。
(2)该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,理由是_________。
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自己被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式: 。
(4)已知单质硫的燃烧热为296 kJ/mol,写出S(s)与O2生成 SO3(g)的热化学方程式: 。
【2015重庆理综化学】我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义。
(1)原子序数为29的铜元素位于元素周期表中第 周期。
(2)某青铜器中Sn、Pb的质量分别为119g、20.7g,则该青铜器中Sn和Pb原子的数目之比为 。
(3)研究发现,腐蚀严重的青铜器表面大都存在CuCl。关于CuCl在青铜器腐蚀过程中的催化作用,下列叙述正确的是 。
| A.降低了反应的活化能 | B.增大了反应的速率 |
| C.降低了反应的焓变 | D.增大了反应的平衡常数 |
(4)采用“局部封闭法”可以防止青铜器进一步被腐蚀。如将糊状Ag2O涂在被腐蚀部位,Ag2O与有害组分CuCl发生复分解反应,该化学方程式为 。
(5)下图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图。
①腐蚀过程中,负极是 (填图中字母“a”或“b”或“c”);
②环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈u2(OH)3Cl,其离子方程式为 ;
③若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为 L(标准状况)。
【2015天津理综化学】(14分)随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。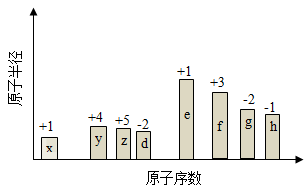
根据判断出的元素回答问题:
(1)f在元素周期表的位置是__________。
(2)比较d、e常见离子的半径的小(用化学式表示,下同)_______>__________;比较g、h的最高价氧化物对应的水化物的酸性强弱是:_______>__________。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式__________。
(4)已知1mole的单质在足量d2中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式:___________。
(5)上述元素可组成盐R:zx4f(gd4)2,向盛有10mL1mol·L-1R溶液的烧杯中滴加1mol·L-1NaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如下: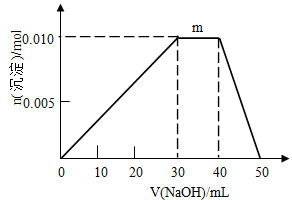
①R离子浓度由大到小的顺序是:__________。
②写出m点反应的离子方程式____________。
③若R溶液改加20mL1.2 mol·L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为_______mol。
【2015四川理综化学】X、Z、Q、R、T、U分别代表原子序数依次增大的短周期元素。X和R属同族元素;Z和U位于第VIIA族;X和Z可形成化合物XZ4;Q基态原子的s轨道和p轨道的电子总数相等;T的一种单质在空气中能够自燃。
请回答下列问题:
(1)R基态原子的电子排布式是_________。
(2)利用价层电子对互斥理论判断TU3的立体构型是______。
(3)X所在周期元素最高价氧化物对应的水化物中,酸性最强的是______(填化学式);Z和U的氢化物中沸点较高的是_____(填化学式);Q、R、U的单质形成的晶体,熔点由高到低的排列顺序是_______(填化学式)。
(4)CuSO4溶液能用作T4中毒的解毒剂,反应可生成T的最高价含氧酸和铜,该反应的化学方程式是_______________________。
【2015安徽理综化学】C、N、O、Al、Si、Cu是常见的六种元素。
(1)Si位于元素周期表第____周期第_____族。
(2)N的基态原子核外电子排布式为_____;Cu的基态原子最外层有___个电子。
(3)用“>”或“<”填空:
| 原子半径 |
电负性 |
熔点 |
沸点 |
| Al_____Si |
N____O |
金刚石_____晶体硅 |
CH4____SiH4 |
(4)常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,反应过程中有红棕色气体产生。
0-t1时,原电池的负极是Al片,此时,正极的电极反应式是_____,溶液中的H+向___极移动,t1时,原电池中电子流动方向发生改变,其原因是______。
【2015上海化学】(本题共12分)
白云石的主要成份是CaCO3·MgCO3,在我国有大量的分布。以白云石为原料生产的钙镁系列产品有广泛的用途。白云石经煅烧、熔化后得到钙镁的氢氧化物,再经过碳化实现Ca2+、Mg2+的分离。碳化反应是放热反应,化学方程式如下:Ca(OH)2 + Mg(OH)2 + 3CO2⇌CaCO3 + Mg(HCO3)2 + H2O
完成下列填空
(1)Ca(OH)2的碱性比Mg(OH)2的碱性 (选填“强”或“弱”)
Ca(OH)2的溶解度比Mg(OH)2的溶解度 (选填“大”或“小”)
(2)碳化温度保持在50~60℃。温度偏高不利于碳化反应,原因是 、 。温度偏低也不利于碳化反应,原因是 。
(3)已知某次碳化时溶液中钙离子浓度随时间的变化如图所示,在10 min到13 min之内钙离子的反 应速率为 。15 min之后钙离子浓度增大,原因是 (用化学方程式表示)。
(4)Mg原子核外电子排布式为 ;Ca原子最外层电子的能量 Mg原子最外层电子的能量(选填“低于”、“高于”或“等于”)。