工业上以氨气为原料(铂铑合金网为催化剂)催化氧化法制硝酸的过程如下:
(1)已知反应一经发生,铂铑合金网就会处于红热状态。写出氨催化氧化的化学方程式:_____。当温度降低时,化学平衡常数K值________(填“增大”“减小”或“无影响”)。
(2)氨气是制取硝酸的重要原料,合成氨反应的化学方程式如下:N2+3H2 2NH3,该反应在固定容积的密闭容器中进行。
2NH3,该反应在固定容积的密闭容器中进行。
①下列各项标志着该反应达到化学平衡状态的是________(填字母)。
| A.容器内N2、H2、NH3的浓度之比为1∶3∶2 |
| B.v正(N2)=v逆(H2) |
| C.容器内压强保持不变 |
| D.混合气体的密度保持不变 |
②若在恒温条件下,将N2与H2按一定比例混合通入一个容积为2 L固定容积的密闭容器中,5 min后反应达平衡时,n(N2)=1.0 mol,n(H2)=0.8 mol,n(NH3)=0.8 mol,则反应速率v(H2) =_____,平衡常数=________。
③若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将 (填“向左移动”“向右移动”或“不移动”)。达到新平衡后,容器内温度 (填“大于”“小于”或“等于”)原来的2倍。
工业上向氨化的CaSO4悬浊液中通入适量CO2,可制取(NH4)2SO4,其流程如下图所示,已知CaSO4的Ksp=9.1×10-6,CaCO3的Ksp=2.8×10-9,请回答:
(1)向甲中通入过量CO2_____(填“有”或“不”)利于CaCO3和(NH4)2SO4的生成,原因是_______________________________________________________________。
(2)直接蒸干滤液得到的(NH4)2SO4主要含有的杂质是________(填含量最多的一种)。
(3)锅炉水垢中含有的CaSO4,可先用Na2CO3溶液浸泡,使之转化为疏松,易溶于酸的CaCO3,而后用酸除去。
①CaSO4转化为CaCO3的离子方程式为____________________________________。
②请分析CaSO4转化为CaCO3的原理:__________________________________________。
在常温、常压、光照条件下,N2在催化剂表面与水发生下列反应:
2N2 (g)+6H2O(l) 4NH3 (g)+3O2 (g)ΔH= a kJ·mol-1
4NH3 (g)+3O2 (g)ΔH= a kJ·mol-1
上述反应NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
| 温度 T/K |
303 |
313 |
323 |
| NH3生成量/(10-6 mol) |
4.8 |
5.9 |
6.0 |
(1)此合成反应的a0 (填“>”、“<”或“=”)。
(2)用水稀释0.1 mol·L-1氨水(设稀释时溶液温度不变),则溶液中随着水量的增加而减小的是下列的(填序号):
A.c(NH3·H2O) B.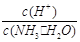 C.c(H+)·c(OH-)D.
C.c(H+)·c(OH-)D.
(3)工业用氨制取硝酸的氧化反应为:4NH3(g)+5O2(g)  4NO(g)+6H2O(g)ΔH<0,若起始的物质的量相同,则下列关系图正确的是________(填序号):
4NO(g)+6H2O(g)ΔH<0,若起始的物质的量相同,则下列关系图正确的是________(填序号):
A B C D
(4)在1L容积固定的密闭容器中发生上述反应,部分物质的物质的量浓度如下表:
| 时间/浓度 |
c(NH3) (mol/L) |
c(O2 ) (mol/L) |
c(NO) (mol/L) |
| 起始 |
0.8000 |
1.600 |
0.000 |
| 第4 min |
0.3000 |
0.9750 |
0.5000 |
| 第6 min |
0.3000 |
0.9750 |
0.5000 |
| 第8 min |
0.7000 |
1.475 |
0.1000 |
反应在第6 min到8min时改变了条件,改变的条件可能是___________________;在该条件下,平衡向_______移动(填“左”或“右”)。
请回答下列问题:
(1)若分别将pH=2的盐酸和醋酸稀释100倍,则稀释后溶液的pH:盐酸醋酸(填“>”、“=”或“<”)。
(2)将100mL0.1mol•L-1的CH3COOH溶液与50mL0.2mol•L-1的NaOH溶液混合,所得溶液呈性,原因是(用离子方程式表示)。
(3)0.1mol·mol-1的氨水溶液中存在电离平衡NH3+H2O  NH3·H2O
NH3·H2O NH4++OH-,在此平衡体系中改变条件(见下表),请完成表中空格:
NH4++OH-,在此平衡体系中改变条件(见下表),请完成表中空格:
| 条件的变化 |
通氨气 |
加水 |
加NH4Cl(s) |
|
| ① |
电离平衡移动的方向 |
|||
| ② |
c(OH-)的变化 |
[第①行填“向左”、“向右”或“不移动” 第②行填“增大”、“减小”或“不变”]
(1)用FeCl3溶液腐蚀印刷电路铜板的化学方程式为:;若将该反应设计成如图的原电池,请在图中完成标注。
(2)实验证明,能设计成原电池的反应通常是放热反应,现有下列反应:
①C(s)+H2O(g)=CO(g)+H2(g)△H>0;
②2H2(g)+O2(g)=2H2O(1)△H<0;
③NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1)△H<0。
上述反应可以设计成原电池的是(填序号),如若以KOH溶液为电解质溶液,依据所选反应设计的原电池其负极反应为。
(1)请回答下列问题:
①已知:①CO(g) + 1/2O2(g) = CO2(g)△H= -283.0kJ·mol-1
②CH3OH(l) + 3/2O2(g) = CO2(g)+2H2O(l)△H= -726.5kJ·mol-1
请写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:____________________________________________________________________;
②已知拆开1molH-H键、1molCl-Cl键、1molH—Cl键分别需要的能量是436kJ、243kJ、432kJ,则反应则反应:H2(g)+ Cl2(g)=2HCl (g) 的△H=。
(2)已知25℃、101 kPa下,稀的强酸与稀的强碱溶液反应的中和热为 -57.3 kJ/mol。
①则表示稀硫酸与稀烧碱溶液中和反应的热化学方程式为:。
②测定中和热实验时所需的玻璃仪器有烧杯、量筒、、。