现有8种元素的性质、数据如下表所列,它们属于第二或第三周期。
回答下列问题:
(1)③的元素符号是 ,⑧的元素名称是 。①在元素周期表中的位置是(周期、族) 。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是 ;名称是 ;碱性最强的化合物是: ;
(3)比较④和⑦的氢化物的稳定性(用化学式表示) 。
(4)写出实验室制取⑦的氢化物的化学方程式 。
(5)写出⑦的氢化物与①的常见单质在Pt催化下反应的化学方程式: 。
(6)写出②最高价氧化物对应水化物跟⑤的氢化物水溶液反应的离子方程式: 。
A、B、C、D四种短周期元素。原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体甲;D的L层电子数等于K、M两个电子层上的电子数之和。
(1)写出下列元素的名称:A_______,B,C_______,D。
(2)D的质子数和中子数相等,D的原子组成符号为,它的最高价为___________价。
(3)用电子式表示A、D两元素形成AD2的过程:;
写出C2B2的电子式。
(4)氢元素与B、D 均可以形成原子个数比为2:1的化合物,H2B的熔沸点高于H2D的原因是
。
(5)写出甲和A的最高价氧化物反应的化学方式:。
(9分)(1)写出下列反应的化学方程式,并注明反应条件和反应类型。
①乙烯和氯化氢反应的化学方程式:_______________________________________,
反应类型:_____________________________________________________________;
②苯和浓硝酸反应的化学方程式:__________________________________________,
反应类型:______________________________________________________________;
③苯和溴反应的化学方程式:_______________________________,
反应类型:______________________________________________________________。
为研究铁质材料与热浓硫酸的反应,某学习小组用碳素钢(即铁和碳的合金)进行了以下探究活动:
[探究一](1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是。
(2)称取碳素钢6.0 g放入15.0 mL浓硫酸中,加热,充分反应后得到溶液X并收集到混合气体Y。
①甲同学认为X中除Fe3+之外还可能含有Fe2+。若要确认其中的Fe2+,应选用(选填序号)。
A.KSCN溶液和氯水 B.铁粉和KSCN溶液
C.浓氨水 D.酸性KMnO4溶液
②乙同学取560 mL(标准状况)气体Y通入足量溴水中,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66 g。由此推知气体Y中SO2的体积分数为。
[探究二]根据上述实验中SO2体积分数的分析,丙同学认为气体Y中还可能含有Q1和Q2两种气体,其中Q1气体,在标准状况下,密度为0.0893 g·L-1。为此设计了下列探究实验装置(假设有关气体完全反应)。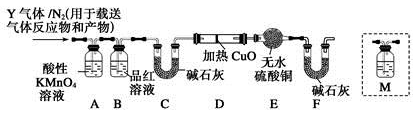
(3)装置B中试剂的作用是。
(4)分析Y气体中的Q2气体是如何生成的(用化学方程式表示)。
(5)已知洗气瓶M中盛装澄清石灰水,为确认Q2的存在,需在装置中添加洗气瓶M于(填序号)。
A.A之前B.A—B间
C.B—C间 D.C—D间
(6)如果气体Y中含有Q1,预计实验现象应是。
(8分)无论是从在国民经济中的地位来看,还是从科学发展的角度来看,硅都发挥着重要的作用。
(1)人类使用硅酸盐产品(陶瓷等)的历史已经快一万年了,但在1823年才获得单质硅,瑞典化学家贝采尼乌斯用金属钾还原SiF4获得单质硅,写出化学方程式_______________ 。
(2)由于制取方法和条件的不同,得到的单质硅形态不同,其性质也不同。
①用铝热法还原氟硅酸钾制得较纯净的晶体硅:4Al+3K2SiF6高温3Si+2KAlF4+2K2AlF5,关于该反应的说法正确的是________(填序号)。
| A.Al是还原剂 | B.氧化产物只有KAlF4 |
| C.每转移6NA电子,得到42 g Si | D.Al元素在KAlF4和K2AlF5中化合价不同 |
②用白砂子与镁粉混合在高温条件下得到无定形硅,反应的化学方程式为___________ 。
(3)在野外,为了迅速得到氢气,用硅粉与干燥的Ca(OH)2和NaOH混合,并加强热,即可迅速得到H2、Na2SiO3、CaO。这种混合物叫做生氢剂。请写出该反应的化学方程式___________________________。
化学与生产、生活息息相关。现有下列6种有机物:①乙炔②涤纶③甲醛④油脂⑤苯酚⑥淀粉,请将相应的序号填入空格内。
(1)水溶液(俗称福尔马林)具有杀菌防腐性能的是___________:
(2)可用于杀菌消毒、制造阿司匹林等,俗称石炭酸的是_____;
(3)通常用于制肥皂的是___________;
(4)能水解生成葡萄糖供机体利用,还可用于酿制食醋、酒的是____;
(5)属于合成纤维的是___________;
(6)常用来焊接或切割金属的是___________。