某科研小组用MnO2和浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理。
(1)请写出SO2与过量NaOH溶液反应的离子方程式:__________________________。
(2)吸收尾气(Cl2)一段时间后,吸收液(强碱性)中肯定存在的阴离子有OH—和 、 。
请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响)
① 提出合理假设。
假设1:只存在SO32—;
假设2:既不存在SO32—也不存在ClO—;
假设3:_____________。
② 要证明假设1是否成立,设计实验方案,进行实验。请在答题卡上写出实验以及预期现象和结论。限选实验试剂:3mol·L-1H2SO4、1mol·L-1NaOH、0.01mol·L-1KMnO4、淀粉-KI溶液。
| 实验 |
预期现象和结论 |
| |
|
2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200oC左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全。电池总反应为:C2H5OH +3O2 =2CO2 +3H2O,电池示意如图: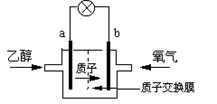
(1)_________极(填a或b)为电池的负极,电池工作时电流方向为______________;
(2)写出电池正极反应方程式___________________;
(3)电池工作时,1mol乙醇被氧化时就有________mol电子转移。
(1)选择适当的试剂除去下列物质中的少量杂质(括号内为杂质):
溴苯(溴):试剂______,反应方程式_________________________;
甲烷(乙烯):试剂______,反应方程式_________________________;
(2)选择合适的试剂鉴别下列物质:
苯和甲苯:试剂__________________________________;
乙烷和乙炔:试剂_____________________________________。
现有A、B、C、D、E五种化合物,它们都是由下表中阴阳离子组合而成。
| 阳离子 |
A13+、Ba2+、Ag+ |
| 阴离子 |
C1-、SO42-、OH- |
为了鉴别它们,分别进行了以下实验,记录如下:
①.A和D都不溶于水,也不溶于稀硝酸;
②.B溶于水后,与上述某阳离子反应可生成A,且B溶液与过量氨水反应生成白色沉淀
③.C溶于水后,与上述某阳离子反应可生成D,且C溶液与过量氨水反应生成白色沉淀。
④.E溶于水后,与上述某阴离子反应可生成A;
⑤.B溶液与适量E溶液反应生成沉淀,再加入过量E溶液,沉淀部分溶解。
(1)根据上述实验结果,写出各物质的化学式:
C , D , E 。
(2)请写出在B溶液中加入过量E溶液对应的离子方程式:
(1)已知草酸(H2C2O4)分解的化学方程式为:H2C2O4 CO↑+ CO2↑+ H2O,下列装置中,可用作草酸分解制取气体的是(填序号)
CO↑+ CO2↑+ H2O,下列装置中,可用作草酸分解制取气体的是(填序号)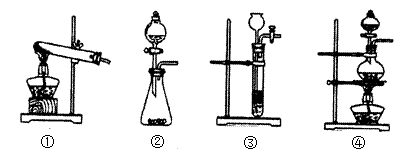
(2)某实验小组为测定铁锈样品的组成(假定铁锈中只有Fe2O3·nH2O和Fe两种成份),利用草酸分解产生的CO和铁锈反应,实验装置如下图所示。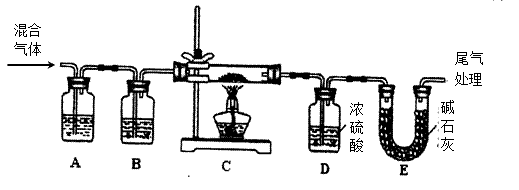
①、为得到干燥、纯净的CO气,洗气瓶A、B中盛放的试剂分别是、。
②、在点燃C处酒精灯之前,应先持续通入一段时间的混合气体,其目的是
③、准确称量样品的质量20.00g置于硬质玻璃管中,充分反应后冷却、称量(假设每步均完全反应),硬质玻璃管中剩余固体质量为16.64g,D中浓硫酸增重1.44g,则n=。
④、在本实验中,下列情况会使测定结果n偏大的是(填字母)
a.缺少装置A b.缺少装置Bc.反应后固体是铁和少量Fe2O3·nH2O
掌握实验室药品的贮存方法,仪器的名称、组装及操作使用是中学化学实验的基础,下图为两套实验装置: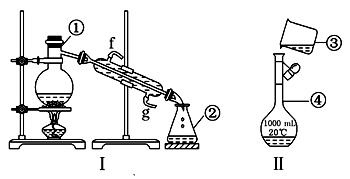
(1)KMnO4通常保存在棕色试剂瓶中,下列试剂不需用棕色试剂瓶保存的是(填字母代号)。
a.浓硝酸 b. 氯水 c. 烧碱溶液
(2)写出下列仪器的名称:① ,④ .
(3)若利用装置Ⅰ分离四氯化碳和酒精的混合物,还缺少的仪器有 ,将仪器补充完整后进行的实验操作的名称为
(4)现需配制250 mL 0.2 mol/L NaCl溶液,装置Ⅱ是某同学转移溶液的示意图,图中的存在的错误是:
①,②;