现有A、B、C、D、E五种化合物,它们都是由下表中阴阳离子组合而成。
| 阳离子 |
A13+、Ba2+、Ag+ |
| 阴离子 |
C1-、SO42-、OH- |
为了鉴别它们,分别进行了以下实验,记录如下:
①.A和D都不溶于水,也不溶于稀硝酸;
②.B溶于水后,与上述某阳离子反应可生成A,且B溶液与过量氨水反应生成白色沉淀
③.C溶于水后,与上述某阳离子反应可生成D,且C溶液与过量氨水反应生成白色沉淀。
④.E溶于水后,与上述某阴离子反应可生成A;
⑤.B溶液与适量E溶液反应生成沉淀,再加入过量E溶液,沉淀部分溶解。
(1)根据上述实验结果,写出各物质的化学式:
C , D , E 。
(2)请写出在B溶液中加入过量E溶液对应的离子方程式:
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”,并收集纯净干燥的气体。请回答该实验中的问题。
(1)写出该反应的化学方程式 ;干燥剂是_________(写名称)。
(2)圆底烧瓶中盛装的水,该装置受热后的主要作用是 ;烧瓶底部放置了几片碎瓷片,其作用是 。
(3)试管中收集气体是 (写化学式),如果要在A处玻璃管处点燃该气体,则必须对该气体进行 。在虚线框内画出收集该气体的装置图。(限选仪器:试管、玻璃导管、水槽)
(4)反应后得到黑色固体,主要成分是Fe3O4,还含有少量Fe和FeO;限选以下试剂:稀HNO3、稀HCl、KSCN溶液、氯水、CuSO4溶液;
设计实验方案检验所得固体中含有Fe3O4,写出实验步骤和实验现象_____________。
‚证明固体中含有没完全反应的Fe____________________________。
根据题目要求填空:
(1)硫、氮的氧化物是主要的大气污染物,对大气的影响之一是导致酸雨。用化学方程式表示NO2形成酸雨的原因: ,该反应中氧化剂和还原剂的物质的量之比为 。
(2)实验室常用的几种气体发生装置如图A、B、C所示: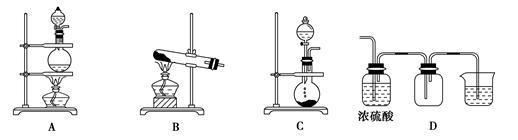
实验室可以用B或C装置制取氨气,如果用B装置,反应的化学方程式是______________;如果用C装置,通常使用的药品是______________(写名称);
‚下图是某学生设计收集氨气的几种装置,其中可行的是______________。
ƒ若用A装置与D装置相连制取并收集X气体,则X可能 是下列气体中的_____________
A.CO2B.NOC.Cl2D.H2
写出A装置中反应的离子方程式_______________。
(3)氢化钠(NaH)是一种还原性极强的物质,广泛应用于工业生产。
氢化钠(NaH)中Na元素的化合价为+1,在高温下氢化钠(NaH)可将四氯化钛(TiCl4)还原成金属钛,该反应的化学方程式为 。
‚NaH能与水剧烈反应:NaH+H2O===NaOH+H2↑,NaH与液氨(NH3)也有类似反应,该反应的化学方程式为_________________________。
如果有12g NaH参加此反应,则转移电子的物质的量为________mol
(4)用SiHCl3与过量H2反应制备纯硅的装置如图所示(热源及夹持装置均已略去):
SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式:_____________;H2还原SiHCl3过程中若混入O2,可能引起的后果是___________;
某学生欲用已知物质的量浓度的盐酸来滴定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂。请填写下列空白:
(1)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视______________。直到_________ _
( 2)下列说法中正确的有
A.滴定管主要用来精确地放出一定体积的溶液
B.碱性溶液和强氧化性溶液应该选择碱式滴定管
C.滴定管润洗的方法是从上口将所要盛装的溶液装满,在从下口将液体放入预置的烧杯中
D.排出碱式滴定管尖嘴部分气泡的方法是打开活塞快速放液以赶走气泡
E.本实验中待测的氢氧化钠溶液需要用量筒来量取
(3)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是_______________
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(4)若滴定开始和结束时,酸式滴定管中的液面如图所示,请将数据填入下面表格的空白处。
| 滴定次数 |
待测氢氧化钠溶液的体积/mL |
0.1000mol/L盐酸的体积(mL)] |
||
| 滴定前刻度 |
滴定后刻度 |
溶液体积/mL |
||
| 第一次 |
25.00 |
|||
| 第二次 |
25.00 |
1.56 |
28.08 |
26.52 |
| 第三次 |
25.00 |
0.22 |
26.34 |
26.12 |
(5)请根据上表中数据列式计算该氢氧化钠溶液的物质的量浓度:c(NaOH)= 。
(I)一种新型的熔融盐燃料电池具有高发电效率而备受重视。现用Li2CO3和Na2CO3的熔融盐混合物做电解质,一极通入CO气体,另一极通入空气与CO2的混合气体,制得燃料电池。该电池工作时的正极反应式为: ;
(II)某课外活动小组用如图装置进行实验,试回答下列问题:
(1)若开始时开关K与a连接,则B极的电极反应为 。 向B极附近滴加铁氰化钾溶液现象是 发生反应的离子方程式
(2)若开始时开关K与b连接,则B极的电极反应为 ,总反应的离子方程式为 。习惯上把该工业生产称为
(3)有关上述实验,下列说法正确的是 。
| A.溶液中Na+向A极移动 |
| B.从A极处逸出的气体能使湿润的KI淀粉试纸变蓝 |
| C.反应很短一段时间后加适量盐酸可恢复到电解前电解质的浓度 |
| D.若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子 |
(4)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
①该电解槽的阳极反应为 。 此时通过阴离子交换膜的离子数 (填“大于”“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口(填“A”、“B”、“C”或 “D”)____________导出。
③电解过程中阴极区碱性明显增强,用平衡移动原理解释原因___________________
人体血液里Ca2+的浓度一般采用mg/cm3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(Ca2C2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用酸性KMnO4溶液定量反应即可测定血样样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度。
【实验探究一】配制酸性KMnO4标准溶液。如上图所示是配制100mL 酸性KMnO4标准溶液的过程示意图。
(1)请你观察图示判断其中不正确的操作有____________(填序号);
(2)其中确定100mL溶液体积的容器是____________(填名称);
(3)如果按照图示的操作所配制溶液进行实验,在其他操作均正确的情况下,所得KMnO4溶液浓度将_________(填“偏大”或“偏小”)。
【实验探究二】测定血液样品中Ca2+的浓度,抽取血样20.00mL,经过上述处理后得到草酸,再用0.020mol/L 酸性KMnO4溶液与之反应,使草酸转化成CO2逸出,这时共消耗12.00mL KMnO4溶液。
(4)已知草酸跟KMnO4反应的离子方程式为:2MnO4-+5H2C2O4+6H+═2Mnx++10CO2↑+8H2O则式中的x=_________
(5)经过计算,血液样品中Ca2+的浓度为___________ mg/cm3。