下列与化学反应能量变化相关的叙述正确的是
| A.生成物的总能量一定低于反应物总能量 |
| B.吸热反应一定要加热条件才能进行 |
| C.同温同压下,H2(g)+Cl2(g)=2HCl(g) 在光照和点燃条件的△H不同 |
| D.用C(s)和CO(g)的燃烧热数据,可以计算化学反应C(s)+1/2O2(g)=CO(g)的焓变 |
下列有关离子检验的操作和实验结论都正确的是
| 选项 |
实验操作及现象 |
实验结论 |
| A |
向某溶液中加入氯化钡溶液,有白色沉淀生成,再加盐酸 化,沉淀不溶解 |
该溶液中一定含有SO42— |
| B |
向某溶液中先加入几滴KSCN溶液,再滴入酸性高锰酸钾溶,溶液变为浅红色 |
该溶液中一定含有Fe2+ |
| C |
在酒精灯上加热铝箔,铝箔熔化,但不滴落,好像有一层膜 兜着 |
铝易被氧化;铝的 熔点比氧化铝低 |
| D |
向某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的无色气体 |
该溶液中一定含有CO32— |
下列离子方程式表示正确的是
| A.AgNO3溶液中加入Cu :Cu+Ag+=Cu2++Ag |
| B.NaHCO3溶液中加入CH3COOH: CO32-+2CH3COOH=CO2↑+2CH3COO-+H2O |
| C.含0.2mol FeBr2的溶液中通入0.2mol Cl2: 4Fe2++6Br-+5Cl2=4Fe3++3Br2+10Cl- |
| D.等体积等物质的量浓度的NaHCO3和Ba(OH)2溶液混合: |
HCO3-+Ba2++OH-=BaCO3↓+H2O
已知常温下在溶液中可发生如下两个离子反应
Ce4++Fe2+= Fe3++Ce3+ Sn2++2Fe3+ = 2Fe2++Sn4+
由此可以确定Fe2+、Ce3+、Sn2+三种离子的还原性由强到弱的顺序是
| A.Sn2+、Fe2+、Ce3+ | B.Sn2+、Ce3+、Fe2+ |
| C.Ce3+、Fe2+、Sn2+ | D.Fe3+、Sn2+、Ce3+ |
Q、W、X、Y、Z是原子序数依次增大的短周期元素,X的焰色反应呈黄色。Q元素的原子最外层电子数是其内层电子数的2倍。W、Z最外层电子数相同,Z的核电荷数是W的2倍。元素Y的合金是日常生活中使用最广泛的金属材料之一,下列说法正确的是
| A.原子半径的大小顺序:rY> rX >rQ>rW |
| B.X、Y的最高价氧化物的水化物之间不能发生反应 |
| C.Z元素的氢化物稳定性大于W元素的氢化物稳定性 |
| D.元素Q和Z能形成QZ2型的共价化合物 |
下列图示实验合理的是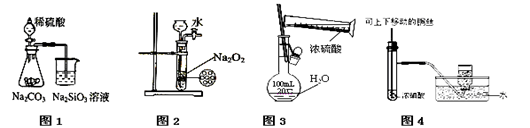
| A.图4为用浓硝酸溶液与铜反应制备并收集少量NO2 |
| B.图2为制备少量氧气 |
| C.图3为配制一定物质的量浓度的硫酸溶液 |
| D.图1为证明非金属性强弱:S>C>Si |