下列说法中正确的是
| A.原电池放电过程中,负极质量一定减轻,或正极的质量一定增加 |
| B.Fe、Cu组成原电池:Fe一定是负极 |
| C.为加快一定量的Zn与足量稀H2SO4反应的速率,且不影响生成H2总量,可加入少量 CuSO4溶液 |
| D.某海水电池总反应表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,则负极反应式:Ag - e-+Cl-=AgCl |
下列有关Fe2(SO4)3溶液的叙述正确的是
| A.该溶液中,K+、Fe2+、C6H5OH、Br-可以大量共存 |
| B.和KI溶液反应的离子方程式:Fe3++2I-===Fe2++I2 |
| C.和Ba(OH)2溶液反应的离子方程式:Fe3++SO42-+Ba2++3OH-===Fe(OH)3↓+BaSO4↓ |
| D.1 L 0.1 mol·L-1该溶液和足量的Zn充分反应,生成11.2 g Fe |
用FeCl3溶液腐蚀印刷电路板上的铜,所得溶液中加入铁粉。对加入铁粉充分反应后的溶液分析合理的是
| A.若无固体剩余,则溶液中一定有Fe3+ |
| B.若有固体存在,则溶液中一定有Fe2+ |
| C.若溶液中有Cu2+,则一定没有固体析出 |
| D.若溶液中有Fe2+,则一定有Cu析出 |
雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl- 。某同学收集了该地区的雾霾,经必要的预处理后得试样溶液,设计并完成了如下的实验: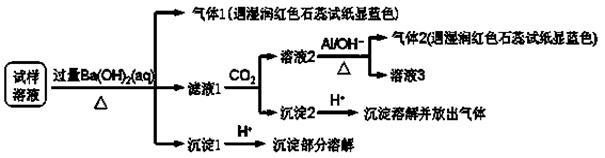
已知:3NO3-+ 8Al + 5OH-+ 2H2O 3NH3 + 8AlO2-
3NH3 + 8AlO2-
根据以上的实验操作与现象,该同学得出的结论不正确的是
| A.试样中肯定存在NH4+、Mg2+、SO42-和NO3- |
| B.试样中一定不含Al3+ |
| C.试样中可能存在Na+、Cl- |
| D.该雾霾中可能存在NaNO3、NH4Cl和MgSO4 |
36.5gHCl溶解在1L水中(水的密度近似为1g·mL-1),所得溶液的密度为ρ g·mL-1,质量分数为w,物质的量浓度为cmol·L-1,NA表示阿伏加德罗常数,则下列叙述正确的是
| A.所得溶液的物质的量浓度:c=1mol·L-1 |
| B.所得溶液中含有NA个HCl分子 |
| C.36.5g HCl气体在标准状况下占有的体积约为22.4L |
| D.所得溶液的质量分数:w=36.5c/ρ |
下列解释事实的方程式不正确的是
A.测0.1mol/L氨水的pH为11:NH3·H2O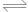 NH4++OH- NH4++OH- |
| B.将Na块放入水中,产生气体:2Na+2H2O=2NaOH+H2↑ |
C.用CuCl2溶液做导电实验,灯泡发光:CuCl2 Cu2++2Cl- Cu2++2Cl- |
| D.Al片溶于NaOH溶液中,产生气体:2Al+2OH-+2H2O=2AlO2-+3H2↑ |